Hvorfor ser mitokondrier ud, som de gør?

Kredit:Wikipedia commons
En af de største udfordringer i biologien i dag er at forklare strukturen af cristae, mitokondriers indre membraner. En forklaring i dette tilfælde er et sæt principper til at forudsige, hvilken form cristae vil antage efter basale metaboliske manipulationer af det miljø, mitokondrierne befinder sig i. Disse principper vil derfor være en beskrivelse af mitokondriernes sande funktion, noget der hidtil kun har næppe forestillet sig.
Nylige fremskridt inden for teknikker som lysmikroskopi med levende celler med superopløsning og elektrontomografi har givet ny indsigt i cristaes dynamiske adfærd. En detaljeret arkitektur af hele mitokondrielle volumen kan nu konstrueres ud fra en række vippebilleder, der projiceres tilbage for at skabe 3D-tomogrammer. I mandags diskuterede vi, hvordan cristae omdannes og omkonfigureres i henhold til overfloden og sundheden af flere indre membran- og matrixproteiner. Påskuddet for denne analyse var de strukturelle og biokemiske ligheder mellem membraner i mitokondrier, thylakoider og myelin, der formentlig hjælper med at kanalisere metabolitter i produktionen af energi.
I en nylig artikel fra The Royal Society's Open Biology , forklarer forskere biogenesen af cristae gennem de koordinerede aktiviteter af fire store veje, der er evolutionært bevaret, fra protister og gær op til højere eukaryoter som os selv:dimerdannelse og oligomerisering af ATP-syntasen ved cristae-kanterne, samling af det 'mitokondrielle kontaktsted' and cristae organizing system' (MICOS) ved crista junctions, membranombygning af en indre membran-associeret, dynamin-relateret GTPase (Mgm1 i gær og OPA1 i pattedyr) og korrekt justering af membranlipidsammensætningen.
For den første vej, der involverer ATP-syntasen, er flere ting tydelige. Som vi rapporterede tidligere, dikterer den spontane dimerisering af ATP-syntase ved præcist definerede og artsafhængige vinkler i ordnede rækker stueetagens geometri. I modsætning til respiratoriske komplekser I-IV, som er samlet på den flade indre grænsemembran, er ATP-syntase (kompleks V) fuldt samlet dybt i cristae-membranerne. Mens adskillige ATP-syntase-underenhedsproteiner er nødvendige for korrekt cristae-dannelse, er Atp20- og Atp21-underenhederne strengt nødvendige.
Et overskud af ADP inducerer en kondenseret konformation med store, opsvulmede intra-kristale rum. I modsætning hertil, under ADP-begrænsende forhold, vedtager mitokondrier den ortodokse konformation med kontraheret intra-krystal rum. I den gigantiske amøbe Chaos carolinensis indeholder mitokondrier normalt tilfældigt orienterede rørformede cristae. Med udsultning antager forstørrede cristae en kubisk morfologi med et zigzag-lignende mønster. Hos mus forårsager apoptotiske midler fusion af individuelle cristae med efterfølgende frigivelse af cytochrom c fra det intra-kristale rum ind i grænseområdet.
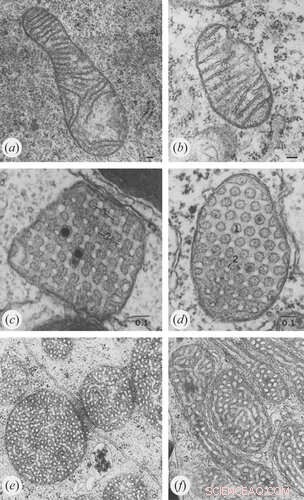
Kredit:Klecker og Westermann, Åben biologi (2021). DOI:10.1098/rsob.210238
For den anden vej, samlingen af MICOS-kontaktsteder, har forskning fastslået, at kritiske proteiner, såsom dem fra den MIC60-relaterede genfamilie, er til stede så langt tilbage som mitokondriers endosymbiotiske forfædre - α-proteobakterierne. Mange af disse tidligere mitokondrielle forbærere viser allerede differentierede intracytoplasmatiske membranstrukturer. Uvægerligt mangler arter, der har forenklet deres mitokondrier til det punkt, at cristae er fraværende, tilsvarende de MICOS-relaterede gener. Genekspression af MIC60-homologer i Δmic60-gærmutanter redder de ultrastrukturelle mitokondrielle defekter.
Den tredje vej omfatter de dynamin-relaterede GTPaser, som koordinerer fusion og fission af både indre og ydre membraner. Ved fission polymeriseres disse proteiner til kontraktile ringe, der anvender sammentrækkende kræfter for at klemme mitokondrier. Resultatet forstås nu at være afhængigt af interaktioner mellem disse proteiner, både med MICOS-komplekset og cristae-forbindelserne, og også de indre og ydre membrantransportsystemer, der samles der. Disse omfatter TIM- og TOM-membrantranslokatorkomplekserne.
Den fjerde vej omfatter selve mitokondriemembranens fosfolipider. Mitokondrier huser cardiolipin-biosyntesevejen og er også involveret i syntesen af phosphatidylethanolamin. Sammen med fosfatidylcholin er det de tre store fosfolipider mitokondrier arbejder med. De fleste af byggestenene til mitokondrielle lipider syntetiseres i ER og skal derfor importeres ind af mekanismer, der involverer tæt apposition til ER. Når først er inde i den ydre membran, medieres fordelingen af lipider af intermembran-rum-lokaliserede transportproteiner fra Ups/PRELI-familien,
Mitokondrier skaber ikke geometri fra bunden, men udnytter og bygger på de naturlige fysiske former, der opstår spontant i lipider. Overladt til deres egen enhed danner lipider koncentriske lamelstrukturer, som derefter kan udvides og forstærkes af specifikke proteiner. Finskalamålinger har nu afsløret, at individuelle cristae er funktionelt uafhængige og kan have væsentligt forskellige membranpotentialer.
Cristae-dannelse involverer et tæt forbundet samspil mellem de ovennævnte fire formgivende påvirkninger. For eksempel er aktiviteterne af MICOS-komplekset og ATP-syntasedimerisering både samarbejdsvillige og antagonistiske. MICOS inducerer negativ membrankrumning, mens ATP-syntasen inducerer positiv krumning ved cristae-spidser og -kanter. Nye beregningsmodeller, som i øjeblikket er under udvikling i laboratorier over hele verden, hvor forholdet mellem disse forskellige komponenter kan finjusteres og justeres, vil i høj grad hjælpe med at definere, hvad der styrer mitokondriers form.
 Varme artikler
Varme artikler
-
 Hvordan tørrotten Serpula lacrymans tilpassede sig et nyt økologisk levestedVist angriber denne kommode:den tørre råd Serpula lacrymans var. lacrymans, en aggressiv nedbryder af det byggede miljø. Kredit:Inger Skrede Ved at sammenligne genetisk information fra lignende or
Hvordan tørrotten Serpula lacrymans tilpassede sig et nyt økologisk levestedVist angriber denne kommode:den tørre råd Serpula lacrymans var. lacrymans, en aggressiv nedbryder af det byggede miljø. Kredit:Inger Skrede Ved at sammenligne genetisk information fra lignende or -
 Undersøgelse gør indhug i landbruget af svanehals-barnaklerKredit:University of Oregon En undersøgelse ledet af en marinebiolog fra University of Oregon har flyttet fiske- og skaldyrsindustrien et skridt tættere på at dyrke svanehals-barnakler, en dyr del
Undersøgelse gør indhug i landbruget af svanehals-barnaklerKredit:University of Oregon En undersøgelse ledet af en marinebiolog fra University of Oregon har flyttet fiske- og skaldyrsindustrien et skridt tættere på at dyrke svanehals-barnakler, en dyr del -
 Embedsmænd:Rethvaler, efter et dødbringende år, kunne uddøI denne 10. april, 2008 filbillede, en nordatlantisk rethval bryder havoverfladen ud for Provincetown, Masse., i Cape Cod Bay. Embedsmænd hos den føderale regering siger, at det er på tide at overveje
Embedsmænd:Rethvaler, efter et dødbringende år, kunne uddøI denne 10. april, 2008 filbillede, en nordatlantisk rethval bryder havoverfladen ud for Provincetown, Masse., i Cape Cod Bay. Embedsmænd hos den føderale regering siger, at det er på tide at overveje -
 Definition af humanbiologiBegrebet humanbiologi angiver de biologiske systemer, som er til stede i menneskekroppen. I undersøgelsen af humanbiologi undersøges de forskellige systemer i kroppen. Sådanne systemer indbefatter k
Definition af humanbiologiBegrebet humanbiologi angiver de biologiske systemer, som er til stede i menneskekroppen. I undersøgelsen af humanbiologi undersøges de forskellige systemer i kroppen. Sådanne systemer indbefatter k
- Mere end ofre:Migrationsbilleder giver en chance for at fortælle en større historie
- Beehjerner: Hvordan disse insekter forbinder symboler med tal
- Navngiv en exoplanet
- Syntese af et af de mest rigelige organiske lipider belyser dets struktur
- En fisk i alle smagsvarianter
- NASA fanger dannelse og sidste skæbne for Eastern Pacifics Tropical Depression 1E


