Hvordan dødelige parasitter vælger at være mandlige:Forskere afslører genekspression på tværs af Cryptosporidiums livscyklus
Enkeltcelleparasitten Cryptosporidium er en førende årsag til dødelig diarrésygdom hos små børn, og et nyligt udbrud i Det Forenede Kongerige fremhæver, hvor sårbar vandforsyningen er over for dette patogen.
Der er ingen effektive lægemidler eller vacciner, hvilket gør dette til en vigtig organisme at studere. Parasitten inficerer cellerne, der beklæder tarmene og engagerer sig i både aseksuel og seksuel replikation, som forskerne formoder er afgørende for vedvarende infektion og overførsel.
Men den mekanisme, hvorved parasitten bliver mand eller kvinde, er ukendt. "Disse parasitter har ikke kønskromosomer, som det menneskelige X eller Y," siger Katelyn A. Walzer, en postdoktor i Striepen Lab i Penn's School of Veterinary Medicine. "At afsløre, hvordan de vælger et køn, er af fundamental biologisk interesse og giver et nyt nøglemål til at blokere transmission og infektion."
Walzer er hovedforfatter af en undersøgelse, offentliggjort i Nature , der afslører genekspressionsprogrammet for hele Cryptosporidiums livscyklus.
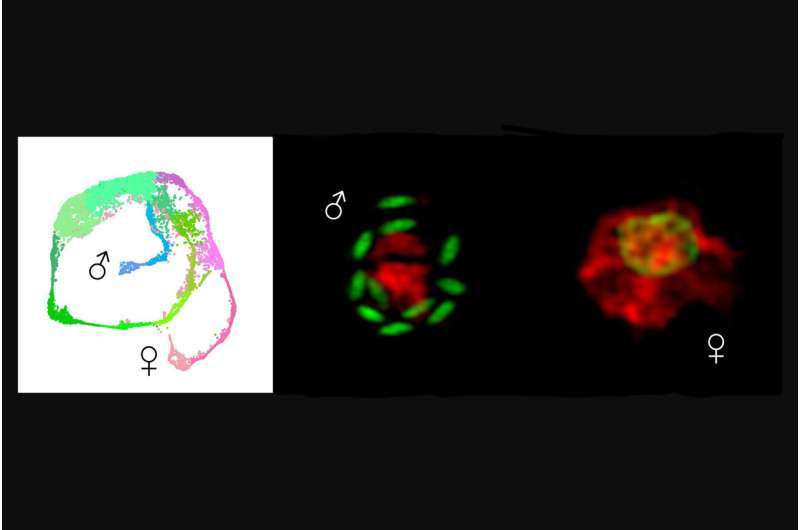
Ved hjælp af RNA-sekventering profilerede forskerne mere end 9.000 parasitter – fra inficerede cellekulturer og mus – og udviklede Cryptosporidium enkeltcelleatlas, som afslører, hvilke gener der udtrykkes på hvilke punkter i hele livscyklussen.
I et andet større fund identificerede forskere den tidligste determinant for mandlighed, et gen kaldet Myb-M.
"Vi viser i dette og andet arbejde, at den seksuelle del af denne livscyklus er afgørende for infektion, og blokering af den gennem parasitprævention vil blokere infektionen," siger seniorforfatter Boris Striepen. Han siger, at ved at forstyrre sex "kan vi muligvis helbrede sygdommen eller svække parasitten for at udvikle en vaccine, så jeg tror, der er et virkelig stærkt translationelt potentiale."
Dette bygger på tidligere forskning, der reviderede livscyklussen til ét med kun tre stadier – en enkelt aseksuel form, mænd og kvinder – mens den fremherskende litteratur foreslog et yderligere mellemstadie.
Walzer forklarer, at Cryptosporidium inficerer mennesker, ofte gennem forurenet vand, i en sporelignende form kaldet en oocyste, som er modstandsdygtig over for vandklorering. Når de først er i tarmen, dukker parasitter op fra sporen for at invadere epitelcellerne, der beklæder tarmen og formere sig i disse celler, før de forlader og invaderer nye tarmceller.
Denne aseksuelle cyklus af invasion, replikation og udgang sker tre gange, før parasitterne differentierer sig til mandlige og kvindelige kønsceller, og derefter fører befrugtning til nye oocyster.
Walzer siger, at gennem denne nye forskning, "har vi en fuld forståelse af alle de gener, der er involveret i hver af disse processer, fra invasion til vækst til deling for derefter at danne den invasive form igen."
Hun siger, at dette atlas giver en detaljeret plan for alle aspekter af parasittens biologi og dens potentielle sårbarheder. Cryptosporidium laver en masse proteiner, der er nødvendige for at invadere og manipulere værten, og holdets arbejde analyserer disse forskellige proteiner baseret på den timing, hvormed deres gener aflæses.
"De invasive former for parasitten kommer med et batteri af våben, der giver dem mulighed for at invadere og overhale vores celler, og dette arsenal er samlet med bemærkelsesværdig tidspræcision," siger Striepen. Han sammenligner det med et samlebånd fra en bilfabrik, hvor nye komponenter bliver lavet lige i tide, og Walzer har udviklet en liste over alle delene, og hvornår de kommer sammen.
Walzer siger, at forskere inden for dette felt er begejstrede for Cryptosporidium-encelleatlaset, fordi de kan slå op i den kontekst, hvori de gener, de studerer, kommer til udtryk. Dette er meget nyttig information for dem, der søger efter lægemiddel- og vaccinemål, da det hjælper med at forudsige de faser af infektion, hvor parasitten kan være mest sårbar.
Ved at konstruere parasitter til at udtrykke fluorescens nåede forskerne også frem til deres andet nøglefund:opdagelsen af transkriptionsfaktoren, hvilket betyder et protein, der regulerer genekspression, som er ansvarlig for mandlighed, Myb-M.
"Når vi tvang parasitten til at lave denne faktor på et hvilket som helst tidspunkt, blev hver parasit hankøn, og da vi tog den væk, udviklede der sig ingen hanner. Det er vigtigt, at begge disse manipulationer blokerede infektionen," siger Walzer.
Striepen siger, at dette fund understreger værdien af parasit-sex som et mål for intervention, og Walzer siger, at denne undersøgelse også "fører os op til at kende det komplette katalog af gener, der kræves til parasit-sex, hvilket giver vigtige spor til mekanismer og translationelle mål." P>
Walzer siger, at hun i fremtidig forskning er interesseret i at følge op på, hvordan Myb-M driver den mandlige skæbne og i mere generelt at forstå, hvordan regulering af transskription driver scenespecifikke forskelle til at orkestrere den komplekse livscyklus.
Flere oplysninger: Katelyn A. Walzer et al., Transcriptional control of the Cryptosporidium life cycle, Nature (2024). DOI:10.1038/s41586-024-07466-1
Journaloplysninger: Natur
Leveret af University of Pennsylvania
 Varme artikler
Varme artikler
-
 Moving muslinger:Ny indsigt i skaldyravlKredit:Pixabay/CC0 Public Domain Forskere har identificeret, hvordan muslingelarver bevæger sig - hvilket giver muslinge- og andre skaldyrsavlere vigtig indsigt i, hvor og hvordan de skal dyrkes.
Moving muslinger:Ny indsigt i skaldyravlKredit:Pixabay/CC0 Public Domain Forskere har identificeret, hvordan muslingelarver bevæger sig - hvilket giver muslinge- og andre skaldyrsavlere vigtig indsigt i, hvor og hvordan de skal dyrkes. -
 Hvad er følelser,og hvorfor har vi dem? På bare et øjeblik, en fysisk fornærmelse mod ansigtet kan fremkalde følelsesmæssig reaktion fra vrede. Se mere i følelsesgalleriet. © iStockphoto.com/Fitzer Hvis du no
Hvad er følelser,og hvorfor har vi dem? På bare et øjeblik, en fysisk fornærmelse mod ansigtet kan fremkalde følelsesmæssig reaktion fra vrede. Se mere i følelsesgalleriet. © iStockphoto.com/Fitzer Hvis du no -
 Kvindelige frugtfluer går ind i ringen af seksuel konkurrenceKredit:CC0 Public Domain Når det kommer til seksuel konkurrence, har mænd stjernerollen. Sammenstødende kroppe, låse horn, bid og spark betragtes alle som fair play. Da denne adfærd er så fremtræde
Kvindelige frugtfluer går ind i ringen af seksuel konkurrenceKredit:CC0 Public Domain Når det kommer til seksuel konkurrence, har mænd stjernerollen. Sammenstødende kroppe, låse horn, bid og spark betragtes alle som fair play. Da denne adfærd er så fremtræde -
 Hvordan det at leve med rovdyr kunne hjælpe indfødte arter med at overleveKredit:Jannico Kelk, Forfatter leveret Når vi slipper en gruppe truede dyr ud i naturen, håber vi altid, at de vil overleve. Det gør de normalt ikke. Vi finder bilby-kroppe under buske, bettangs re
Hvordan det at leve med rovdyr kunne hjælpe indfødte arter med at overleveKredit:Jannico Kelk, Forfatter leveret Når vi slipper en gruppe truede dyr ud i naturen, håber vi altid, at de vil overleve. Det gør de normalt ikke. Vi finder bilby-kroppe under buske, bettangs re
- Forskning viser, at det nu er tid til at beskytte det vestlige Australiens høje skove
- Store virksomheder bliver snart nødt til at oplyse om deres klimarisiko – men vil det hjælpe?
- Optiske effekter af den divalente funktionalisering af kulstofnanorør
- Japanske videnskabsmænd undersøger kilden til høj varme på asteroide
- Neanderthal næse:Desto bedre at ånde med
- Ny teknologi fuldender vital klasse af industrielle reaktioner fem gange hurtigere


