Forskere afslører, hvordan acetylering regulerer centromerdynamik, kromosomadskillelse og mitotisk progression
Celledeling producerer nye celler, som understøtter livsproliferation og udvikling. Mitose er den korteste og mest dynamiske fase i cellecyklussen. Under mitose er kromosomerne jævnt fordelt mellem de to datterceller, hvilket bevarer genomets integritet.
Centromeren, en specialiseret region af kromosomet, tjener som en rekrutteringsplatform for forskellige proteiner, der er afgørende for at opretholde søsterkromatid-kohæsion og for samling af kinetochorer. Disse kinetochorer er ansvarlige for vedhæftningen af spindelmikrotubuli, som muliggør kromosomsammenfald og korrekt adskillelse under celledeling.
Defekter i centromerens struktur eller funktion kan føre til kromosomfejlsegregering, hvilket igen kan resultere i genomisk ustabilitet.
Bub1 (spirende uhæmmet af benzimidazol 1) er en serin/threoninkinase, der udfører forskellige funktioner under mitose. Det rekrutteres til ubundne kinetochorer under prometafase og fremmer rekrutteringen af andre nedstrømsproteiner til kinetochorerne og centromererne.
Proteinacetylering er en konserveret post-translationel modifikation, der findes i både prokaryoter og eukaryoter. I 1964 opdagede forskere første gang acetylering af histoner. Efterfølgende undersøgelser afslørede, at ikke kun histoner, men også talrige ikke-histonproteiner er genstand for acetyleringsmodifikationer, som er involveret i reguleringen af forskellige cellulære livsaktiviteter.
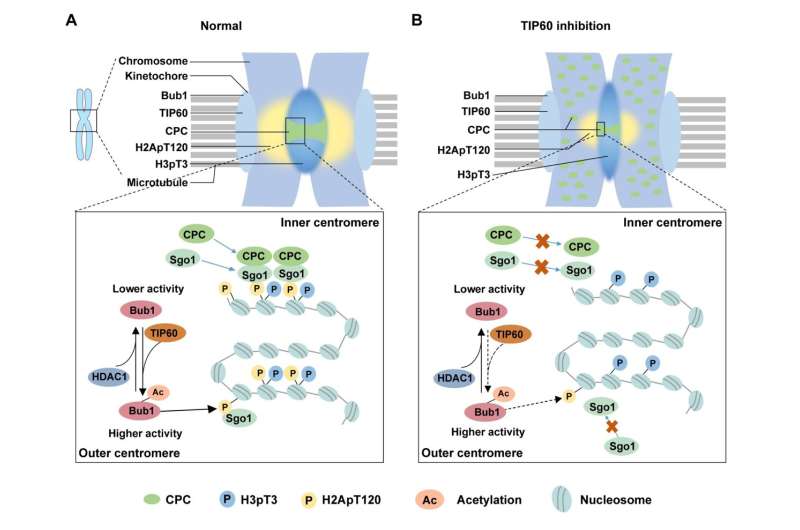
Prof. Chuanmao Zhang og kolleger ved Kunming University of Science and Technology og Peking University har fundet en molekylær mekanisme, der regulerer kromosomsammenfald og -segregation. Forskerne har vist i deres papir offentliggjort i Science China Life Sciences , TIP60 acetylerer Bub1 ved K424 og K431 på kinetochorer under tidlig mitose, hvilket øger kinaseaktiviteten af Bub1.
"Da vi berigede de mitotiske acetylerede proteiner, opdagede vi Bub1 blandt dem," sagde Mengjie Sun, den første forfatter af papiret. "Ydermere observerede vi en betydelig stigning i acetyleringsniveauet af Bub1 under tidlig mitose. Dette tyder på, at Bub1-acetylering kan have en rolle at spille i processen."
Dette er begyndelsen på deres forskning. Og så, gennem en række eksperimenter, som inkluderer levende cellebilleddannelse og biokemiske teknikker, opdagede de, at Bub1-acetylering er afgørende for korrekt kromosomsammenfald og segregation. Forringet Bub1-acetylering forårsager en betydelig forsinkelse i kromosomtilpasning og defekter i kromosomsegregering, herunder haltende kromosomer og anafasebrodannelse.
Dernæst fandt de gennem in vivo og in vitro eksperimenter, at acetyltransferase TIP60 er ansvarlig for Bub1-acetyleringen.
Desuden dykkede forskerne i at undersøge, hvordan Bub1-acetylering, medieret af TIP60, regulerer kromosomsammenfald og -segregation. De opdagede indvirkningen på rekrutteringen af nedstrømsproteiner til centromererne og fandt ud af, at CPC-komponenterne og Sgo1 ikke var i stand til effektivt at blive rekrutteret til centromererne, når Bub1-acetyleringen blev afbrudt.
Tidligere undersøgelser har rapporteret, at Bub1 phosphorylerer H2A ved T120 (H2ApT120) for at rekruttere CPC og Sgo1. Forskerne søgte derefter at bestemme, hvordan Bub1-acetylering påvirker niveauet af H2ApT120. Som de forventede, øger Bub1-acetylering dens kinaseaktivitet og fremmer derved phosphoryleringen af H2A.
"Dette er den mekanisme, hvorved Bub1-acetylering regulerer kromosomsammenfald og -adskillelse," konkluderede prof. Zhang.
I betragtning af at acetyleringen af Bub1 er en dynamisk proces gennem hele cellecyklussen, sigtede de også på at identificere det enzym, der er ansvarligt for deacetylering af Bub1. De udpegede en essentiel deacetylase, HDAC1, som medierer deacetyleringen af Bub1, når celler forlader mitose. For tidlig deacetylering af Bub1 af HDAC1 kan forringe kinaseaktiviteten af Bub1 og føre til unormal centromeradskillelse og kromosomfejlsegregering.
"Dette danner en acetylerings- og deacetyleringscyklus af Bub1 i cellecyklussen," forklarede Dr. Biying Yang.
Flere oplysninger: Mengjie Sun et al., TIP60-acetylering af Bub1 regulerer centromer H2AT120-phosphorylering til trofast kromosomadskillelse, Science China Life Sciences (2024). DOI:10.1007/s11427-023-2604-8
Journaloplysninger: Science China Life Sciences
Leveret af Science China Press
 Varme artikler
Varme artikler
-
 Afslører denne dinosaurkirkegård deres sidste dag på jorden? En ekspert udforsker beviserneKredit:Pixabay/CC0 Public Domain Begravet i klipperne i North Dakota ligger beviser for den nøjagtige dag, hvor dinosaurerne blev udslettet fra planeten, for omkring 66 millioner år siden. Det er p
Afslører denne dinosaurkirkegård deres sidste dag på jorden? En ekspert udforsker beviserneKredit:Pixabay/CC0 Public Domain Begravet i klipperne i North Dakota ligger beviser for den nøjagtige dag, hvor dinosaurerne blev udslettet fra planeten, for omkring 66 millioner år siden. Det er p -
 Hvilken stor signatur kan sige om din personlighedHvad ville Einstein synes om grafologi? Universal History Archive/UIG via Getty Images Fra hjerter over bogstavet jeg til skrab, der knap er læselige, signaturstile varierer lige så meget som de menn
Hvilken stor signatur kan sige om din personlighedHvad ville Einstein synes om grafologi? Universal History Archive/UIG via Getty Images Fra hjerter over bogstavet jeg til skrab, der knap er læselige, signaturstile varierer lige så meget som de menn -
 Magpies kan danne venskaber med mennesker - sådan herKredit:CC0 Public Domain Kan man danne et venskab med en magpie? – selv når voksne hanner beskytter deres reder i løbet af swooping sæsonen? Det korte svar er:Ja, man kan - selvom videnskaben lige
Magpies kan danne venskaber med mennesker - sådan herKredit:CC0 Public Domain Kan man danne et venskab med en magpie? – selv når voksne hanner beskytter deres reder i løbet af swooping sæsonen? Det korte svar er:Ja, man kan - selvom videnskaben lige -
 Tørke- og barkbiller dræber de ældste træer på Jorden. Kan træerne reddes?Kredit:Pixabay/CC0 Public Domain Skovpatolog Martin MacKenzie strøg frem på en smal sti gennem Californiens mytiske granskov i de hvide bjerge nær Nevada-grænsen, hvor han metodisk scannede knudred
Tørke- og barkbiller dræber de ældste træer på Jorden. Kan træerne reddes?Kredit:Pixabay/CC0 Public Domain Skovpatolog Martin MacKenzie strøg frem på en smal sti gennem Californiens mytiske granskov i de hvide bjerge nær Nevada-grænsen, hvor han metodisk scannede knudred
- Mød udholdenhed, JPLs nyeste Mars-rover
- Atlanterhavets orkansæson 2020 var en rekord-smasher-og den rejste flere bekymringer om klimaændri…
- Fairyfloss -asteroider - et vindue ind i det tidlige solsystem
- Er populistiske ledere et ansvar under COVID-19?
- Ny tilgang til maskinlæring er bedre til at se enzymatiske metaller i proteiner
- Religion er enestående menneskelig, men computersimuleringer kan hjælpe os med at forstå religiø…


