Forskere afslører dynamisk struktur af FLVCR-proteiner og deres funktion i næringsstoftransport
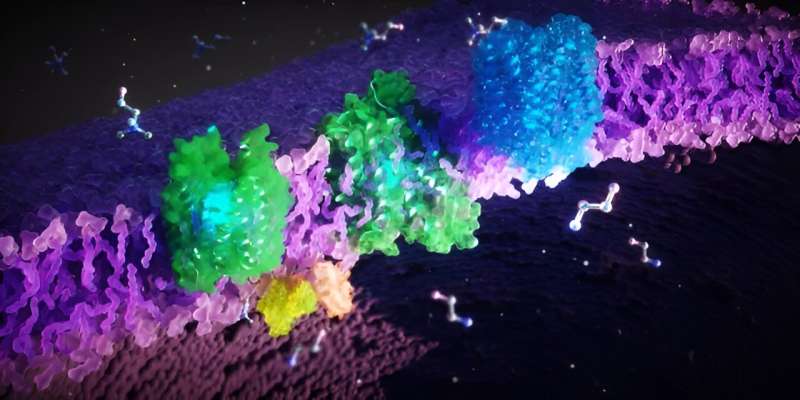
Det er kendt, at funktionsfejl i proteinerne FLVCR1 og FLVCR2 fører til sjældne arvelige sygdomme hos mennesker, der forårsager motoriske, sensoriske og neurologiske lidelser. De biokemiske mekanismer bag dette og de fysiologiske funktioner af FLVCR-proteinerne har dog hidtil været uklare.
Et tværfagligt team af forskere fra Frankfurt am Main, Singapore og USA har nu dechifreret FLVCR-proteinernes 3D-strukturer og deres cellulære funktioner. Forskerne har vist, at proteinerne transporterer de cellulære byggesten cholin og ethanolamin. Deres resultater bidrager væsentligt til at forstå patogenesen af sjældne sygdomme og udvikle nye terapier.
I tv-serier på hospitaler søger læger efter korrekte diagnoser og mulige behandlinger for patienter med nogle gange forvirrende eller mærkelige symptomer. I virkeligheden tager denne proces ofte år for dem, der er ramt af sjældne sygdomme. I mange tilfælde er der ingen effektiv medicin, og de terapeutiske muligheder er begrænsede.
Cirka 6%-8% af verdens befolkning lider af en sjælden sygdom. Det er omkring 500 millioner mennesker, selvom hver af de mere end 7.000 forskellige sygdomme kun rammer omkring 1 ud af 2.000 mennesker. Da disse sygdomme er så sjældne, er den medicinske og videnskabelige viden om dem begrænset. Der er kun få eksperter verden over, og social bevidsthed mangler.
Afdækning af proteiners struktur og funktion for at forstå sygdomme og udvikle terapier
Et internationalt team af forskere ledet af Schara Safarian, projektgruppeleder ved Max Planck Institute of Biophysics samt uafhængig gruppeleder ved Fraunhofer Institute for Translational Medicine and Pharmacology ITMP, og Institut for Klinisk Farmakologi ved Goethe Universitet Frankfurt, har nu undersøgt strukturen og cellulær funktion af to proteiner, FLVCR1 og FLVCR2, som spiller en årsagsrolle i en række sjældne arvelige sygdomme.
Forskerne har offentliggjort deres resultater i Nature .
Fejlfunktioner af FLVCR1 og FLVCR2 på grund af genmutationer forårsager sjældne sygdomme, hvoraf nogle resulterer i alvorlige syns-, mobilitets- og sensoriske lidelser - såsom posterior kolonneataksi med retinitis pigmentosa, Fowlers syndrom eller sensoriske og autonome neuropatier. Sidstnævnte kan for eksempel føre til et fuldstændigt tab af smertefornemmelse.
"I mange sygdomme, inklusive de sjældne, ændres cellulære strukturer i vores krop, og det fører til funktionsfejl i biokemiske processer," siger Schara Safarian. "For at forstå udviklingen af sådanne sygdomme og udvikle terapier, er vi nødt til at vide, hvordan disse proteiner er struktureret på molekylært niveau, og hvilke funktioner de udfører i raske celler."
FLVCR1 og FLVCR2 transporterer de cellulære byggesten cholin og ethanolamin
Forskerne har opdaget, at FLVCR 1 og FLVCR2 transporterer molekylerne cholin og ethanolamin gennem membranerne i vores celler. "Kolin og ethanolamin er afgørende for vigtige kropsfunktioner. De understøtter vækst, regenerering og stabilitet af vores celler, for eksempel i muskler, indre organer og hjernen," forklarer Safarian.
"Ydermere er cholin involveret i fedtstofskiftet og afgiftning i leveren. Vores krop har også brug for det til at producere neurotransmitteren acetylcholin, som er afgørende for vores nervesystem og er nødvendig af vores hjerne for at kontrollere organerne. Så du kan forestille dig, at det ikke fungerer korrekt. af FLVCR-proteinerne kan forårsage alvorlige neurologiske og muskulære lidelser."
Forskerne brugte mikroskopiske, biokemiske og computerstøttede metoder til at undersøge FLVCR-proteinerne. "Vi chokfrosset proteinerne og observerede dem derefter under et elektronmikroskop," forklarer Di Wu, forsker ved Max Planck Institute of Biophysics og medforfatter af undersøgelsen. "En elektronstråle trænger ind i den frosne prøve, og elektronernes interaktion med materialet skaber et billede."
Forskerne tager mange individuelle billeder og behandler og kombinerer dem beregningsmæssigt for at opnå højopløselige 3D-strukturer af proteiner. På denne måde var de i stand til at dechifrere strukturerne af FLVCR1 og FLVCR2 og se, hvordan de ændrer sig i nærvær af ethanolamin og cholin. Computersimuleringer bekræftede og visualiserede, hvordan FLVCR-proteinerne interagerer med ethanolamin og cholin og dynamisk ændrer deres struktur for at muliggøre transport af næringsstoffer.
Safarian opsummerer:"Vores resultater baner vejen for at forstå udviklingen og progressionen af sjældne sygdomme forbundet med FLVCR-proteinerne. I fremtiden kan patienterne muligvis drage fordel af nye behandlingsformer, der genopretter deres livskvalitet."
Flere oplysninger: Keiken Ri et al, Molekylær mekanisme for cholin- og ethanolamintransport hos mennesker, Nature (2024). DOI:10.1038/s41586-024-07444-7
Journaloplysninger: Natur
Leveret af Max Planck Society
 Varme artikler
Varme artikler
-
 5 måder din hjerne påvirker dine følelserDu føler dig trist, men det er ikke kun fordi du var skuffet i dag. iStockphoto/Thinkstock Tristhed fra hjertesorg, glæde over at finde en for længst tabt ven, angst før en jobsamtale - du vil måske
5 måder din hjerne påvirker dine følelserDu føler dig trist, men det er ikke kun fordi du var skuffet i dag. iStockphoto/Thinkstock Tristhed fra hjertesorg, glæde over at finde en for længst tabt ven, angst før en jobsamtale - du vil måske -
 Hvordan en harmløs miljøbakterie blev til den frygtede hospitalskim Acinetobacter baumanniiScanningelektronmikrografi af en klynge af gramnegative, immobile bakterier af Acinetobacter baumannii-arterne. Kredit:Janice Carr, CDCs Public Health Image Library Billede #6498 Hvert år bliver me
Hvordan en harmløs miljøbakterie blev til den frygtede hospitalskim Acinetobacter baumanniiScanningelektronmikrografi af en klynge af gramnegative, immobile bakterier af Acinetobacter baumannii-arterne. Kredit:Janice Carr, CDCs Public Health Image Library Billede #6498 Hvert år bliver me -
 Hvordan planter aktiverer deres immunsystem mod patogener i regnMekaniske stimuli initierer den koncentriske udbredelse af intercellulære calciumbølger væk fra trichomer. Kredit:Yasuomi Tada Mens regn er afgørende for planters overlevelse, indeholder det også b
Hvordan planter aktiverer deres immunsystem mod patogener i regnMekaniske stimuli initierer den koncentriske udbredelse af intercellulære calciumbølger væk fra trichomer. Kredit:Yasuomi Tada Mens regn er afgørende for planters overlevelse, indeholder det også b -
 Raffinering af pesticider for at dræbe skadedyr, ikke bierForskere ved Michigan State Universitys entomologiske afdeling har låst en nøgle op for at bevare insekticidets effektivitet til at eliminere skadedyr uden at dræbe gavnlige insekter, såsom bier. Stud
Raffinering af pesticider for at dræbe skadedyr, ikke bierForskere ved Michigan State Universitys entomologiske afdeling har låst en nøgle op for at bevare insekticidets effektivitet til at eliminere skadedyr uden at dræbe gavnlige insekter, såsom bier. Stud
- Forskere er tæt på kræftbehandlinger ved hjælp af CRISPR
- Opvarmning af Arktis er ny normal, vil påvirke os alle:rapport (Opdatering 2)
- Soldrevet kemi bruger kuldioxid og vand til at fremstille råmaterialer til brændstoffer, kemikalie…
- Digital skade:Forurener dit onlineliv planeten?
- Har et af matematikkens største mysterier, Riemann-hypotesen, endelig blevet løst?
- At sætte en stopper for plastisk adskillelsesangst


