Undersøgelse kaster lys over, hvordan antibiotisk velcro dræber bakterier

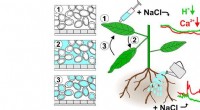
Et lille antibiotikum kaldet plectasin bruger en innovativ mekanisme til at dræbe bakterier. Ved at samles i store strukturer låser plectasin sig fast på sit mål på bakteriecelleoverfladen, på samme måde som begge sider af velcro danner en binding.
Et forskerhold, ledet af strukturbiolog Markus Weingarth og biokemiker Eefjan Breukink ved Utrecht University, kortlagde, hvordan velcro-strukturen er dannet. Deres opdagelse, offentliggjort i Nature Microbiology , løfter sløret for en ny tilgang, der kan have brede implikationer for udviklingen af antibiotika til bekæmpelse af antimikrobiel resistens.
Forskerholdet undersøgte virkningen af plectasin, et antibiotikum afledt af svampen Pseudoplectania nigrella. Holdet anvendte avancerede biofysiske teknikker, herunder faststof-NMR, og i samarbejde med Wouter Roos fra Groningen, atomkraftmikroskopi.
Traditionelt fungerer antibiotika ved at målrette mod specifikke molekyler i bakterieceller. Mekanismen bag plectasins virkning var dog ikke fuldt ud forstået indtil nu. Tidligere undersøgelser har foreslået en konventionel model, hvor plectasin binder til et molekyle kaldet Lipid II, som er afgørende for bakteriel cellevægssyntese, beslægtet med en nøgle, der passer ind i en lås.
Den nye undersøgelse afslører en mere indviklet proces. Plektasin virker ikke bare som en nøgle i en lås; i stedet danner det tætte strukturer på bakteriemembraner indeholdende Lipid II. Disse supramolekylære komplekser fanger deres mål Lipid II og forhindrer det i at undslippe. Selv hvis en Lipid II bryder fri fra plectasin, forbliver den indeholdt i velcro-strukturen, ude af stand til at undslippe.
Weingarth sammenligner denne struktur med velcro, hvor plectasin danner de mikroskopiske kroge, der fastgøres til bakterielle "løkker". I normal velcro, hvis en af løkkerne bryder fri fra sin krog, er den stadig fanget af hele strukturen. Det samme gælder bakterier fanget i plectasin-overbygningen:De kan bryde fri fra plectasinets binding, men forblive fanget i overbygningen. Dette forhindrer bakterierne i at undslippe og forårsage yderligere infektioner.

Desuden fandt forskerne, at tilstedeværelsen af calciumioner yderligere øger plectasins antibakterielle aktivitet. Disse ioner koordinerer med specifikke områder af plectasin, hvilket forårsager strukturelle ændringer, der væsentligt forbedrer den antibakterielle effektivitet. At ioner spiller en afgørende rolle i virkningen af plectasin blev opdaget af Ph.D. studerende Shehrazade Miranda Jekhmane og Maik Derks, medforfattere af undersøgelsen. De indså, at plectasinprøver havde en ejendommelig farve, som antydede tilstedeværelsen af ioner.
Markus Weingarth, hovedforfatteren af undersøgelsen, forventer, at denne opdagelse kan åbne nye veje til at udvikle overlegne antibiotika.
"Plectasin er formentlig ikke den ideelle antibiotikakandidat på grund af sikkerhedshensyn. Men i vores undersøgelse viser vi, at 'Velcro-mekanismen' forekommer meget brugt blandt antibiotika, som hidtil blev ignoreret. Fremtidige lægemiddeldesignbestræbelser er derfor ikke kun nødvendigt at fokus på, hvordan man binder mål, men også hvordan lægemidler effektivt kan samle sig selv. Derved lukker vores undersøgelse et stort videnshul, som kan have brede implikationer for design af bedre lægemidler til at bekæmpe den voksende trussel om antimikrobiel resistens,« siger han.
Flere oplysninger: Værtsforsvarspeptid plectasin retter sig mod bakteriel cellevæg-precursor Lipid II ved hjælp af en calciumfølsom supramolekylær mekanisme, Nature Microbiology (2024). DOI:10.1038/s41564-024-01696-9
Journaloplysninger: Naturmikrobiologi
Leveret af Utrecht University
 Varme artikler
Varme artikler
-
 Gråhvalers forsvinden fra Atlanterhavet giver et fingerpeg om mulig tilbagevendenGråhvaler kan blive op til 15 meter lange og veje op til 40 tons – svarende til den samlede vægt af omkring 20 biler. Kredit:© ArtDary, Shutterstock Gråhvalen er i fokus for forskningsprojekter, de
Gråhvalers forsvinden fra Atlanterhavet giver et fingerpeg om mulig tilbagevendenGråhvaler kan blive op til 15 meter lange og veje op til 40 tons – svarende til den samlede vægt af omkring 20 biler. Kredit:© ArtDary, Shutterstock Gråhvalen er i fokus for forskningsprojekter, de -
 Flere observationer af en truet art betyder ikke altid, at den kommer sigLeadbeaters possum-observationer er øget - men det betyder ikke, at den kritisk truede art er ved at komme sig. Kredit:David Lindenmeyer, Forfatter angivet Hvis der registreres flere observationer
Flere observationer af en truet art betyder ikke altid, at den kommer sigLeadbeaters possum-observationer er øget - men det betyder ikke, at den kritisk truede art er ved at komme sig. Kredit:David Lindenmeyer, Forfatter angivet Hvis der registreres flere observationer -
 Trivende undervandshaver fundet ud for Wellingtons kystSvampe på et dybvandsrev ud for Kapiti-kysten. Kredit:Victoria University of Wellington En enorm mangfoldighed af havliv, inklusive farvestrålende svampe, er blevet fundet i dybvandsrev ud for Well
Trivende undervandshaver fundet ud for Wellingtons kystSvampe på et dybvandsrev ud for Kapiti-kysten. Kredit:Victoria University of Wellington En enorm mangfoldighed af havliv, inklusive farvestrålende svampe, er blevet fundet i dybvandsrev ud for Well -
 Er det etisk at bruge stamceller?En petriskål af menneskelige embryoner, der er bestemt til et stamcelleforskningslaboratorium Sandy Huffaker/Getty Images Stamceller har et stort løfte om at hjælpe os med at forstå og behandle mange
Er det etisk at bruge stamceller?En petriskål af menneskelige embryoner, der er bestemt til et stamcelleforskningslaboratorium Sandy Huffaker/Getty Images Stamceller har et stort løfte om at hjælpe os med at forstå og behandle mange
- Ultratynde optiske fibre tilbyder en ny måde at 3D-printe mikrostrukturer på
- Evaluering af succesen med biokatalyse fra lægemidler til miljøteknologi
- Microsoft gennemgår, hvordan det efterforsker ukorrekt opførsel på kontoret
- Online læring:Hvad giver det dig?
- Astronomer opdager en ny ekstragalaktisk cirkulær radiokilde
- Forbundet champagne sætter en prop i falsk bobler


