Universalt klemmeprotein stabiliserer foldede proteiner:Ny indsigt i, hvordan chaperonen Hsp70 virker
Oversigt:
Chaperonen Hsp70 spiller en kritisk rolle i forskellige cellulære processer, herunder proteinfoldning, proteinnedbrydning og proteinhandel. Denne undersøgelse afslører en ny mekanisme, hvormed Hsp70 stabiliserer foldede proteiner. Chaperoneproteinet Hsp70 udfører flere væsentlige opgaver i celler. Det hjælper proteiner med at folde sig til deres rigtige former, forhindrer dem i at samle sig og reparerer beskadigede proteiner. Dette sikrer, at proteiner er i stand til at udføre deres roller i kroppen.
Hsp70 opnår disse funktioner ved at binde sig til proteiner på en reguleret måde. I denne undersøgelse har forskere opdaget en ny mekanisme, hvormed Hsp70 kan binde og stabilisere foldede proteiner. De har identificeret en molekylær switch i Hsp70, der gør det muligt at "klemme" fast på foldede proteiner og forhindre dem i at udfolde sig.
Forståelse af denne nye mekanisme kan hjælpe med at udvikle nye behandlingsformer for sygdomme, hvor proteiner fejlfolder og aggregerer, såsom Alzheimers og Parkinsons sygdomme.
Nøglefund:
- Hsp70 interagerer med foldede proteiner på en ATP-afhængig måde ved hjælp af dets ATPase-domæne.
- Tilstedeværelsen af ADP i ATPase-lommen inducerer konformationelle ændringer i Hsp70, hvilket får det til at klemme fast på foldede proteiner.
- Klemmemekanismen forhindrer udfoldning af foldede proteiner og beskytter dem mod aggregering.
Betydning:
Undersøgelsen giver ny indsigt i de molekylære mekanismer, hvormed chaperonen Hsp70 stabiliserer foldede proteiner og forhindrer deres aggregering. Denne viden kan bidrage til udviklingen af terapeutiske strategier for protein-fejlfoldende sygdomme.
 Varme artikler
Varme artikler
-
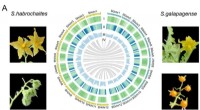 Genomer af vilde tomater tilbyder en værdifuld ressource til forbedring af tomaterKarakteristika for S. habrochaites og S. galapagense genomerne:A. Genomisk landskab af S. habrochaites og S. galapagense; B. Fylogeni af ti Solanaceae-arter med estimerede divergenstider; C. SV større
Genomer af vilde tomater tilbyder en værdifuld ressource til forbedring af tomaterKarakteristika for S. habrochaites og S. galapagense genomerne:A. Genomisk landskab af S. habrochaites og S. galapagense; B. Fylogeni af ti Solanaceae-arter med estimerede divergenstider; C. SV større -
 Krivende genetiske parasitter kan føre til nyt forsvar mod farlige bakterierFunktioner af plasmider, der koder for CRISPR-Cas-komponenter. (A) Mobilitetsforudsigelser for indsamlingen af ikke-redundante proteobakterielle plasmider analyseret i denne undersøgelse, præsentere
Krivende genetiske parasitter kan føre til nyt forsvar mod farlige bakterierFunktioner af plasmider, der koder for CRISPR-Cas-komponenter. (A) Mobilitetsforudsigelser for indsamlingen af ikke-redundante proteobakterielle plasmider analyseret i denne undersøgelse, præsentere -
 Matematik gør det muligt for videnskabsmænd at forstå organisationen i en cellekerneKlasser af transkriptionsklynger. I en selvbærende transkriptionsklynge er en TF og genet, der koder for den TF, begge til stede. De inter- og intrakromosomale eksempler i henholdsvis (a) og (b) illus
Matematik gør det muligt for videnskabsmænd at forstå organisationen i en cellekerneKlasser af transkriptionsklynger. I en selvbærende transkriptionsklynge er en TF og genet, der koder for den TF, begge til stede. De inter- og intrakromosomale eksempler i henholdsvis (a) og (b) illus -
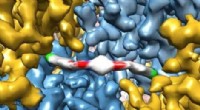 Fremskridt i kryo-elektronmikroskopi bringer liv på atomniveau til et klarere synEt banebrydende kryo-elektronmikroskopibillede viser ekstremt detaljeret, hvordan et nyt terapeutisk molekyle interagerer med et protein, giver forskere indsigt i, hvordan det fungerer i menneskekropp
Fremskridt i kryo-elektronmikroskopi bringer liv på atomniveau til et klarere synEt banebrydende kryo-elektronmikroskopibillede viser ekstremt detaljeret, hvordan et nyt terapeutisk molekyle interagerer med et protein, giver forskere indsigt i, hvordan det fungerer i menneskekropp
- En halv grad af opvarmning kan have stor indflydelse på vandtilgængeligheden
- Pandemisk maskebjerg sætter ny genbrugsudfordring
- Diaforureningsniveauer udviser kortsigtet vippeadfærd over den nordkinesiske slette
- Et kig på 377 metroer – kan lokale fødevarer imødekomme lokale husholdningers efterspørgsel?
- Grafitbelægning gør perovskit-solceller vandtætte
- Statsfinansieret forskning fremmer i stigende grad innovation


