Ny mikroskopimetode bryder farvebarrieren for optisk billeddannelse
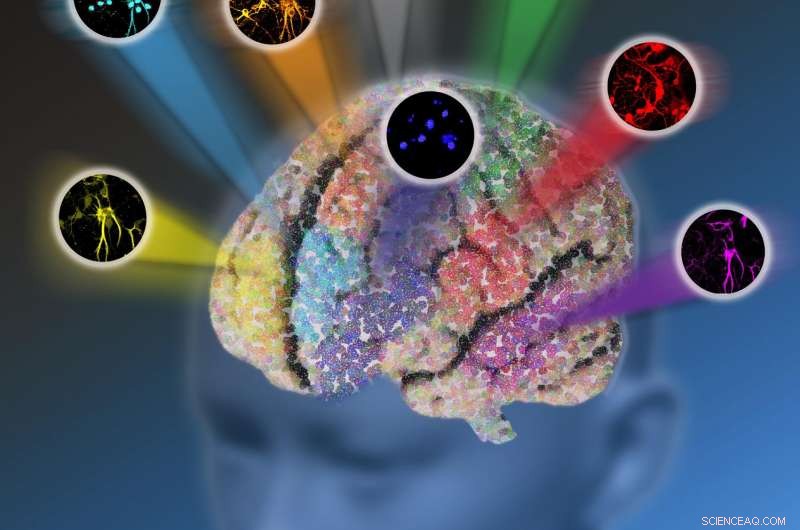
Forskere ved Columbia University udviklede en ny optisk mikroskopiplatform kaldet elektronisk præ-resonansstimuleret Raman-spredning (epr-SRS) mikroskopi, der kombinerer et højt niveau af følsomhed og selektivitet. Den innovative teknik giver mulighed for billeddannelse af op til 24 biomolekylære strukturer ad gangen i stedet for at være begrænset af kun fem fluorescerende proteiner. Kredit:Nicoletta Barolini, Columbia University
Forskere ved Columbia University har taget et væsentligt skridt hen imod at bryde den såkaldte "farvebarriere" af lysmikroskopi for biologiske systemer, giver mulighed for meget mere omfattende, systemdækkende mærkning og billeddannelse af et større antal biomolekyler i levende celler og væv, end det i øjeblikket er muligt. Fremskridtet har potentiale til mange fremtidige applikationer, herunder hjælpe med at vejlede udviklingen af terapier til behandling og helbredelse af sygdom.
I en undersøgelse offentliggjort online 19. april i Natur , holdet, ledet af lektor i kemi Wei Min, rapporterer udviklingen af en ny optisk mikroskopiplatform med drastisk forbedret detektionsfølsomhed. Derudover undersøgelsen beskriver skabelsen af nye molekyler, der, når den er parret med den nye instrumentering, give mulighed for samtidig mærkning og billeddannelse af op til 24 specifikke biomolekyler, næsten fem gange antallet af biomolekyler, der kan afbildes på samme tid med eksisterende teknologier.
"I systembiologiens æra, hvordan man samtidig afbilder et stort antal molekylære arter inde i celler med høj følsomhed og specificitet er fortsat en stor udfordring for optisk mikroskopi, " sagde Min. "Det, der gør vores arbejde nyt og unikt, er, at der er to synergistiske stykker - instrumentering og molekyler - der arbejder sammen for at bekæmpe denne langvarige forhindring. Vores platform har kapaciteten til at transformere forståelsen af komplekse biologiske systemer:det store menneskelige cellekort, metaboliske veje, funktionerne af forskellige strukturer i hjernen, det indre miljø af tumorer, og makromolekylesamling, for blot at nævne nogle få."
Alle eksisterende metoder til at observere en række strukturer i levende celler og væv har deres egne styrker, men alle er også hindret af fundamentale begrænsninger, ikke mindst eksistensen af en "farvebarriere".

Forskere ved Columbia University udviklede en ny optisk mikroskopiplatform kaldet elektronisk præ-resonansstimuleret Raman-spredning (epr-SRS) mikroskopi, der kombinerer et højt niveau af følsomhed og selektivitet. Den innovative teknik giver mulighed for billeddannelse af op til 24 biomolekylære strukturer ad gangen i stedet for at være begrænset af kun fem fluorescerende proteiner. Kredit:Nicoletta Barolini, Columbia University
Fluorescensmikroskopi, for eksempel, er ekstremt følsom og som sådan, er den mest udbredte teknik, der bruges i biologiske laboratorier. Mikroskopet gør det muligt for forskere at overvåge cellulære processer i levende systemer ved at bruge proteiner, der bredt omtales som "fluorescerende proteiner" med normalt op til fem farver. Hvert af de fluorescerende proteiner har en målstruktur, som påfører et "tag, " eller farve til. De fem fluorescerende proteiner, eller farver, typisk brugt til at mærke disse strukturer er BFP (Blue Fluorescent Protein), ECFP (cyan fluorescerende protein), GFP (Grønt Fluorescerende Protein), mVenus (gult fluorescerende protein), og DsRed (rødt fluorescerende protein).
På trods af sine styrker, fluorescensmikroskopi hæmmes af "farvebarrieren, "hvilket begrænser forskerne til maksimalt kun at se fem strukturer ad gangen, fordi de anvendte fluorescerende proteiner udsender en række uadskillelige nuancer, der som resultat, falder i fem brede farvekategorier.
Hvis en forsker forsøger at observere alle de hundredvis af strukturer og forskellige celletyper i en levende hjernetumorvævsprøve, for eksempel, hun ville være begrænset til kun at se op til fem strukturer ad gangen på en enkelt vævsprøve. Hvis hun ville se mere end de fem, hun skulle rense vævet for de fluorescerende etiketter, hun brugte til at identificere og mærke de sidste fem strukturer for at bruge de samme fluorescerende etiketter til at identificere et andet sæt af op til fem strukturer. Hun ville være nødt til at gentage denne proces for hvert sæt af op til fem strukturer, hun ønsker at se. Det er ikke kun arbejdskrævende at observere maksimalt fem strukturer ad gangen, men ved rengøring af vævet, vitale komponenter i dette væv kan gå tabt eller beskadiges.
"Vi vil gerne se dem alle på samme tid for at se, hvordan de opererer på egen hånd, og også hvordan de interagerer med hinanden, " sagde Lu Wei, hovedforfatter på undersøgelsen og en postdoc-forsker i Min-laboratoriet. "Der er masser af komponenter i et biologisk miljø, og vi skal være i stand til at se alting samtidigt for virkelig at forstå processerne."

Forskere ved Columbia University udviklede en ny optisk mikroskopiplatform kaldet elektronisk præ-resonansstimuleret Raman-spredning (epr-SRS) mikroskopi, der kombinerer et højt niveau af følsomhed og selektivitet. Den innovative teknik giver mulighed for billeddannelse af op til 24 biomolekylære strukturer ad gangen i stedet for at være begrænset af kun fem fluorescerende proteiner. Kredit:Nicoletta Barolini, Columbia University
Ud over fluorescensmikroskopi, der er i øjeblikket en række Raman-mikroskopiteknikker i brug til at observere levende celle- og vævsstrukturer, der virker ved at synliggøre vibrationerne, der stammer fra karakteristiske kemiske bindinger i strukturer. Traditionel Raman-mikroskopi producerer de højt definerede farver, der mangler i fluorescensmikroskopi, men mangler følsomheden. Som sådan, det kræver en stærk, koncentreret vibrationssignal, der kun kan opnås gennem tilstedeværelsen af millioner af strukturer med den samme kemiske binding. Hvis signalet fra de kemiske bindinger ikke er stærkt nok, visualisering af den tilknyttede struktur er næsten umuligt.
For at løse denne udfordring, Min og hans team, herunder Profs. Virginia Cornish i kemi og Rafael Yuste i neurovidenskab, forfulgte en ny hybrid af eksisterende mikroskopiteknikker.
De udviklede en ny platform kaldet elektronisk præ-resonansstimuleret Raman-spredning (epr-SRS) mikroskopi, der kombinerer det bedste fra begge verdener, kombinerer et højt niveau af følsomhed og selektivitet. Den innovative teknik identificerer, med ekstrem specificitet, strukturer med væsentligt lavere koncentration - i stedet for millioner af den samme struktur, der er nødvendig for at identificere tilstedeværelsen af den struktur i traditionel Raman-mikroskopi, det nye instrument kræver kun 30 til identifikation. Teknikken bruger også et nyt sæt tagging-molekyler designet af teamet til at arbejde synergistisk med den ultramoderne teknologi. Den forstærkede "farvepalet" af molekyler udvider tagging-kapaciteten, giver mulighed for billeddannelse af op til 24 strukturer ad gangen i stedet for at være begrænset af kun fem fluorescerende farver. Forskerne mener, at der er potentiale for yderligere udvidelse i fremtiden.
Holdet har med succes testet epr-SRS-platformen i hjernevæv. "Vi var i stand til at se de forskellige celler arbejde sammen, " sagde Wei. "Det er styrken ved en større farvepalet. Vi kan nu oplyse alle disse forskellige strukturer i hjernevæv samtidigt. I fremtiden håber vi at se dem fungere i realtid." Hjernevæv er ikke det eneste, forskerne forestiller sig, at denne teknik bliver brugt til, tilføjede hun. "Forskellige celletyper har forskellige funktioner, og videnskabsmænd studerer normalt kun én celletype ad gangen. Med flere farver, vi kan nu begynde at studere flere celler samtidigt for at observere, hvordan de interagerer og fungerer både på egen hånd og sammen under sunde forhold versus i sygdomstilstande."
Den nye platform har mange potentielle applikationer, Min sagde, tilføjer, at det er muligt, at teknikken en dag kan bruges i behandlingen af tumorer, der er svære at dræbe med tilgængelige lægemidler. "Hvis vi kan se, hvordan strukturer interagerer i kræftceller, vi kan identificere måder at målrette specifikke strukturer mere præcist på, " sagde han. "Denne platform kunne være spilskiftende i jagten på at forstå alt, der har mange komponenter."
 Varme artikler
Varme artikler
-
 Udnyttelse af ikke-line-of-sight-stier til terahertz-signaler i trådløs kommunikationRepræsentation af en sender (venstre), der udsender et signal med stærk vinkelspredning. Hver frekvens er repræsenteret af en anden farve og kommer ud i en anden retning, som producerer en regnbuelign
Udnyttelse af ikke-line-of-sight-stier til terahertz-signaler i trådløs kommunikationRepræsentation af en sender (venstre), der udsender et signal med stærk vinkelspredning. Hver frekvens er repræsenteret af en anden farve og kommer ud i en anden retning, som producerer en regnbuelign -
 Observere og kontrollere ultrahurtige processer med attosecond opløsningProf. Dr. Birgitta Bernhardt med måleopstillingen ved Institut for Fysik på Münchens Tekniske Universitet. Kredit:Michael Mittermair / TUM Mange kemiske processer går så hurtigt, at de kun er noge
Observere og kontrollere ultrahurtige processer med attosecond opløsningProf. Dr. Birgitta Bernhardt med måleopstillingen ved Institut for Fysik på Münchens Tekniske Universitet. Kredit:Michael Mittermair / TUM Mange kemiske processer går så hurtigt, at de kun er noge -
 Ingeniører skaber spiralformede topologiske exciton-polaritoner, en ny type quasiparticleTil venstre, et billede af Agarwal -gruppens enhed, et enkelt lag wolframdisulfid (WS2) på en periodisk mønstret fotonisk krystal. Stærk kobling mellem excitonerne i WS2 med den fotoniske krystal føre
Ingeniører skaber spiralformede topologiske exciton-polaritoner, en ny type quasiparticleTil venstre, et billede af Agarwal -gruppens enhed, et enkelt lag wolframdisulfid (WS2) på en periodisk mønstret fotonisk krystal. Stærk kobling mellem excitonerne i WS2 med den fotoniske krystal føre -
 Hvad hvis nogen frigiver en stor mængde helium?Frigivelse af helium til et lille rum kan påvirke evreyones stemmer, men de vil ikke være så høje i tonehøjde, som de ville sutte direkte på en ballon. Foto høflighed iStockPhoto At tale er en fantas
Hvad hvis nogen frigiver en stor mængde helium?Frigivelse af helium til et lille rum kan påvirke evreyones stemmer, men de vil ikke være så høje i tonehøjde, som de ville sutte direkte på en ballon. Foto høflighed iStockPhoto At tale er en fantas


