Single-shot 3D bredfelts fluorescensbilleddannelse med et beregningsmæssigt miniaturemesoskop
Online omslag - et Computational Miniature Mesoscope (CM2). Billedkredit:Xue et al., Videnskabens fremskridt, doi:10.1126/sciadv.abb7508
Online-funktionen forsidebillede på Videnskabens fremskridt denne uge viser fluorescensbilleddannelse med et computational miniature mesoscope (CM 2 ). Teknikken til fluorescensbilleddannelse er et væsentligt værktøj for biologer og neurovidenskabsmænd; imidlertid, konventionelle mikroskoper og miniaturiserede mikroskoper (miniskoper) er begrænset af et produkt med begrænset plads-båndbredde - en måling af informationskapaciteten i et optisk system, lav dybdeskarphed og manglende evne til at opløse tredimensionelle (3-D) distribuerede emittere. For at overvinde eksisterende grænser, Yujia Xue og et team af forskere inden for el- og computerteknik, biologi, neurofotonik og biomedicinsk teknik ved Boston University, OS., udviklet et let og kompakt mesoskop kendt som beregningsminiaturemesoskopet (CM 2 ).
Den nye platform integrerede en mikrolinse til billeddannelse og et LED-array til excitation i samme opsætning. Enheden udførte single-shot 3D-billeddannelse og muliggjorde en 10 gange synsfeltforstærkning og en 100 gange dybdeskarphedsforbedring, sammenlignet med eksisterende miniskoper. Xue et al. testede enheden med fluorescerende perler og fibre sammen med fantomeksperimenter for at måle virkningerne af bulkspredning og baggrundsfluorescens. Holdet diskuterer det praktiske ved dette mesoskop til brede anvendelser inden for biomedicin og 3-D neural optagelse.
Fremadskridende fluorescensmikroskopi
Fluorescensmikroskopi er en nøgleteknik inden for grundlæggende biologi og systemneurovidenskab. Den seneste teknologiske udvikling er rettet mod at overvinde skalabarrierer for at undersøge individuelle neuroner på kun få mikron i størrelse. For eksempel, makroskoper, mesolens mikroskoper og to-foton mikroskoper er begyndt at bygge bro over denne skala; imidlertid, udviklingen af sådanne billeddannelsessystemer er begrænset af skalaafhængige geometriske aberrationer af optiske elementer. Det opnåelige synsfelt (FOV) er også begrænset af systemets lave dybdeskarphed i mange biobilleddannelsesapplikationer. Forskere er også fokuseret på at miniaturisere teknologien for at tillade in vivo-billeddannelse i frit opførende dyr. For eksempel, miniaturiserede mikroskoper kendt som 'miniskoper' har fået hidtil uset adgang til neurale signaler, selvom systemerne fortsat er begrænset af deres optik, meget som deres modstykker til fluorescensmikroskopi. Xue et al. derfor introduceret og demonstreret et beregningsmæssigt miniaturemikroskop (CM 2 ) med stor skala, 3D-fluorescensmålinger på en kompakt, letvægts platform.
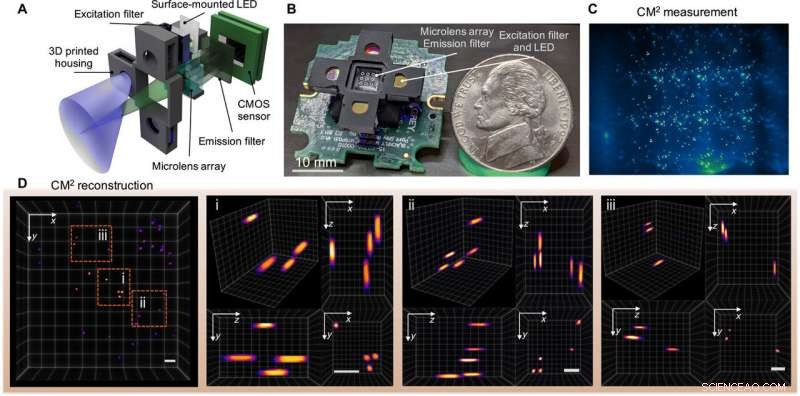
Single-shot 3D fluorescens CM2. (A) CM2 kombinerer en MLA-optik og lys-emitterende diode (LED) array excitation i en kompakt og let platform. (B) Billede af CM2 -prototypen (de elektriske ledninger og sensordriveren udelades). Billedkredit:Yujia Xue, Boston Universitet. (C) CM2-måling på 100 μm fluorescerende partikler suspenderet i klar harpiks. (D) Projiceret visning af det CM2-rekonstruerede volumen (7,0 mm gange 7,3 mm gange 2,5 mm) og tre zoom-ind-områder med ortogonale visninger. Målestænger, 500 μm. CMOS, komplementær metal-oxid-halvleder. Kredit:Science Advances, doi:10.1126/sciadv.abb7508 
Holdet brugte simpel optik i opsætningen til at opnå forbedring af space-bandwidth product (SBP) og 3-D billeddannelsesmuligheder uden behov for mekanisk scanning. Teknikken omgik de fysiske grænser for den integrerede optik ved i fællesskab at designe hardwaren og algoritmen. CM 2 billeddannelsesmetoden kombinerede flere forskellige funktioner ved mikroskopisk billeddannelse, såsom integreret billeddannelse, lysfeltsmikroskopi og billeddiagnostik med kodet blænde. I sin virkningsmekanisme, mikroskopet opsamlede en enkelt 2-D måling ved hjælp af et mikrolinsearray (MLA) til efterfølgende beregningsmæssig rekonstruktion af 3-D fluorescensfordelingen.
CM 2 brugte mikrolinsearrayet som det eneste billeddannende element og gjorde det muligt for opsætningen at overvinde synsfeltsgrænserne (FOV) pålagt af objektivlinsen i konventionelle mikroskoper. CM 2 algoritmen løste 2-D-til-3-D-dekonvolutionsproblemet for at give dybdeløste rekonstruktioner. Xue et al. forklarede princippet om CM 2 single-shot 3-D billeddannelseskapacitet ved at tegne en analogi til frekvensdelingsmultipleksing (FDM). Holdet kvantificerede derefter den opnåelige opløsning af CM 2 ved at beregne 3D-modulationsoverførselsfunktionen (MTF) af systemet og analysere den laterale opløsning.
Karakterisering af CM2's billeddannelsesprincip, skift varians, og opløsning. (A) CM2 producerer aksialt varierende array PSF'er for at opnå optisk sektionering. Den aksiale forskydning i sidefokuserne er godt karakteriseret ved den geometriske model, der præsenteres i undersøgelsen. PCC'en for de aksialt scannede PSF'er kvantificerer den forventede aksiale opløsning. EM, udledning. (B) 3D MTF (vist i log-skala) viser, at CM2 fanger udvidet aksial frekvensinformation og forstørrer systemets SBP. Understøttelsen af den eksperimentelle MTF stemmer overens med teorien (i stiplet stiplet kurve). Vinklen på hvert vippede “bånd” i MTF sættes af den vinkelrette placering af de tilsvarende mikrolins αMLA (i stiplede linjer). (C) den laterale forskydningsvarians er karakteriseret ved PCC for de lateralt scannede PSF'er. PSF i det centrale FOV (markeret med orange grænselinjer) indeholder 3 × 3 foci; PSF i det ydre FOV (markeret med blå grænselinjer) indeholder 2 × 3 eller 3 × 2 foci; PSF i hjørnet FOV (markeret med gule grænselinjer) indeholder 2 × 2 foci. (D) Opløsningen i forskellige områder af FOV er kendetegnet ved at rekonstruere et 5-μm pinhole-objekt ved hjælp af CM2's skift-invariante model. Den laterale fulde bredde ved halv maksimum (FWHM) er konsekvent under 7 μm. Den aksiale FWHM er ~139 μm i den centrale FOV og nedbrydes til ~172 og ~ 189 μm i de ydre og hjørne FOV'er, henholdsvis. (E) Geometri til billeddannelse af et vippet fluorescerende mål. (F) Rå CM2-måling. (G) MIP'er for det rekonstruerede volumen (8,1 mm gange 5,5 mm gange 1,8 mm). 7-μm funktionerne (gruppe 6, element 2) kan løses som vist i zoom-in xy-projektionen. Den aksiale sektionsevne er karakteriseret ved xz-projektionen, validering af den funktionsstørrelsesafhængige aksiale opløsning. Kredit:Science Advances, doi:10.1126/sciadv.abb7508 
Xue et al. tilnærmede billeddannelsen af CM 2 opsætning ved at bruge en skivevis skift-invariant model. De karakteriserede opløsningen og lateral skiftvarians af opsætningen før eksperimentel billeddannelse og afbildede et fluorescerende opløsningsmål for at validere den laterale opløsning af CM 2 . De validerede observationerne ved hjælp af Zemax-simulerede målinger for at finde en god overensstemmelse mellem simuleringerne og eksperimenterne. Den nye platform gjorde det muligt for forskerne at lokalisere fluorescerende emittere fordelt over et stort volumen. De testede ydelsen af CM 2 på prøver med en egenskabsstørrelse svarende til en enkelt neuron. Under disse forsøg, CM 2 algoritmen var tolerant over for signalforringelser såsom reducerede signal-til-støj-forhold for at muliggøre høj kvalitet, fuld-synsfelt rekonstruktion. Holdet sammenlignede CM 2 rekonstruktion og en aksial stak erhvervet af en objektivlinse for at demonstrere nøjagtigheden af enkeltskudslokalisering af individuelle partikler.
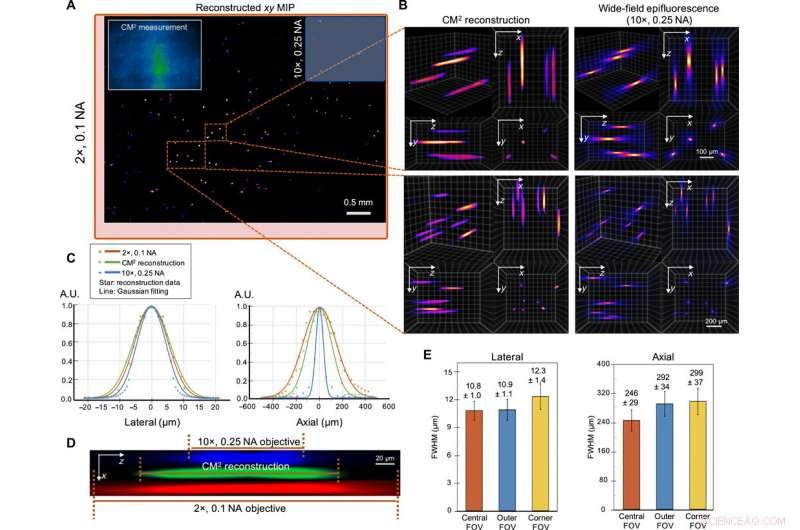
Single-shot 3D-billeddannelse af 10-μm fluorescerende partikler i et klart volumen. (A) xy MIP af det rekonstruerede volumen spænder over 5,7 mm gange 6,0 mm gange 1,0 mm. Øverst til venstre:Rå CM2-måling. FOV af CM2 kan sammenlignes med en 2× objektivlinse (rød afgrænsningsramme) og er ~25× bredere end 10× objektivlinsen (blå afgrænsningsramme). (B) Zoom ind på CM2 3D-rekonstruktionen benchmarkeret af den aksiale stak taget af en 10×, 0,25 NA objektiv linse. (C) Laterale og aksiale tværsnit af den genvundne 10-μm partikel. Ved at sammenligne med målingerne fra standard wide-field fluorescensmikroskopi, CM2 genskaber trofast partiklens laterale profil og opnår enkelt-skuds dybdesektionering. A.U., vilkårlige enheder. (D) xz tværsnitsbillede af en rekonstrueret fluorescerende partikel, sammenlignet med den aksiale stak opnået fra 2× og 10× objektivlinser. (E) For at karakterisere de rumlige variationer af rekonstruktionen, statistikken for de laterale og aksiale FWHM'er af de rekonstruerede partikler er plottet for den centrale, ydre, og hjørne FOV. Den laterale bredde ændrer sig kun lidt (~0,9 %) i den ydre FOV, men øges i hjørne FOV (~13,9 %). Den aksiale forlængelse nedbrydes fra ~246 μm i det centrale FOV til ~292 og ~ 299 μm i de ydre og hjørne FOV-regioner, henholdsvis. Kredit:Science Advances, doi:10.1126/sciadv.abb7508
Eksperimenter på fluorescerende fibre på en buet overflade og på kontrollerede spredningsfantomer.
Forskerne testede derefter evnen til at afbilde komplekse volumetriske fluorescerende prøver på fluorescerende fibre spredt på en 3-D printet buet overflade, efterligner overfladeprofilen af en musebark, spænder over et bredt synsfelt og en udvidet dybde. Algoritmen genoprettede nøjagtigt fokusstrukturerne og løste for 3D-objektet, samtidig med at de fleste af de enkelte fibre løses. Holdet udførte yderligere eksperimenter på otte billeddannelsesfantomer for at teste ydeevnen af CM 2 under bulkspredning og stærk baggrundsfluorescens. Under forsøgene, de podede alle fantomer med den samme koncentration af målfluorescerende partikler og krediterede forskellene i rekonstruktion til bulkspredning og baggrundsfluorescens. Holdet inkluderede derefter 1,1 µm baggrundsfluorescerende partikler for at efterligne uopløselige fluorescerende kilder, der almindeligvis ses på biologiske prøver; såsom neutropiler i hjernen. De kvantificerede spredningsniveauet for hvert fantom, udførte 3-D rekonstruktion for hvert spredningsfantom og udførte alle dekonvolutioner ved hjælp af den samme beregningsindstilling. Det estimerede rekonstruktionsdybdeinterval varierede med overfladevariationer til stede i hvert fantom.

Rekonstruktion af fluorescerende fibre. Filmfilen visualiserer den volumetriske rekonstruktion af fluorescerende fibre på en buet overflade. Til sammenligning, dybdekortet estimeret ud fra fokalstakken fra et widefield epifluorescensmikroskop med en 2×, 0,1 NA objektivlinse vises. Kredit:Science Advances, doi:10.1126/sciadv.abb7508
På denne måde Yujia Xue og kolleger udviklede et nyt miniaturiseret fluorescensbilleddannelsessystem for at muliggøre enkelt-shot mesoskopisk 3D-billeddannelse. Det beregningsmæssige miniaturemesoskop (CM 2 ) metode integreret fluorescensbilleddannelse og excitationsmodulerne på den samme kompakte platform. Holdet præsenterede simuleringerne og eksperimenterne for at etablere virkningsmekanismen og 3D-billeddannelseskapaciteten for CM 2 . De simulerede hjernedækkende billeddannelse af vaskulære netværk, og de primære resultater var lovende. CM 2 prototypen er endnu ikke sammenlignelig med hovedmonterede in vivo-applikationer (på dyremodeller) i neurovidenskabelige laboratorier, selvom teamet forestiller sig at optimere enheden til fuld-kortikal in vivo-billeddannelse i frit bevægende mus. Billeddannelsesenheden kan forbedres yderligere med yderligere udvikling af hardware og algoritmer for at åbne nye og spændende muligheder inden for in vivo neural optagelse og biomedicinske applikationer.
© 2020 Science X Network
 Varme artikler
Varme artikler
-
 Undersøgelse sætter spørgsmålstegn ved teorier om pulsarfænomenerPulsaren afbilledet her, der befinder sig i Messier 82-galaksen 12 millioner lysår væk, sender røntgenstråler, der passerer Jorden hvert 1,37 sekund. Forskere, der studerede dette objekt med NuSTAR, t
Undersøgelse sætter spørgsmålstegn ved teorier om pulsarfænomenerPulsaren afbilledet her, der befinder sig i Messier 82-galaksen 12 millioner lysår væk, sender røntgenstråler, der passerer Jorden hvert 1,37 sekund. Forskere, der studerede dette objekt med NuSTAR, t -
 Et fysikperspektiv på sårhelingFluorescerende mikroskopibillede af en prolifererende cellefront, hvis kant er markeret med grønt. Rotteepitelcellerne, med cytoplasma (blå) og kerner (rød), danne en 2-dimensionel kultur, som kan bru
Et fysikperspektiv på sårhelingFluorescerende mikroskopibillede af en prolifererende cellefront, hvis kant er markeret med grønt. Rotteepitelcellerne, med cytoplasma (blå) og kerner (rød), danne en 2-dimensionel kultur, som kan bru -
 Orienteret hexagonal bornitrid fremmer ny type informationsbærerOverfladen repræsenterer lavenergibåndene af dobbeltlagsgrafen omkring K-dalen, og farven på overfladen angiver størrelsen af Berry-krumning, der fungerer som en ny informationsbærer. Når det øverst
Orienteret hexagonal bornitrid fremmer ny type informationsbærerOverfladen repræsenterer lavenergibåndene af dobbeltlagsgrafen omkring K-dalen, og farven på overfladen angiver størrelsen af Berry-krumning, der fungerer som en ny informationsbærer. Når det øverst -
 Fysikere splittede irreversibelt fotoner ved at fryse dem ned i et Bose-Einstein-kondensat(fra venstre) Frank Vewinger, Martin Weitz, David Dung, Erik Busley og Christian Kurtscheid i laboratoriet ved Institut for Anvendt Fysik ved University of Bonn. Kredit:(c) Volker Lannert/Uni Bonn
Fysikere splittede irreversibelt fotoner ved at fryse dem ned i et Bose-Einstein-kondensat(fra venstre) Frank Vewinger, Martin Weitz, David Dung, Erik Busley og Christian Kurtscheid i laboratoriet ved Institut for Anvendt Fysik ved University of Bonn. Kredit:(c) Volker Lannert/Uni Bonn


