Sådan beregnes plasma Osmolarity
Hent koncentrationerne for de opløste stoffer, som du ønsker at beregne plasma osmolariteten til. De mest almindelige opløste stoffer er natrium (Na +), glucose og blodurinstofkvælstof (BUN).
Konverter mg /dl til standardenhederne millimol per liter (mmol /L). At konvertere deciliter til liter, multiplicer med 10. For at omdanne milligram til millimoler divideres med molekylvægten. Derfor konverteres mg /dl til mmol /L, multipliceres med 10 /Ds, hvor Ds er molekylvægten af opløsningen s.
Beregn 10 /Ds, hvor Ds er molekylvægten for glucose og BUN. Molekylvægten for glucose er 180, så 10 /Ds for glucose er 1/18. BUN er diatomisk nitrogen (N2), så dets molekylvægt er 28. Derfor er 10 /Ds for BUN 10/28 = 1 /2.8. Vi har nu en plasma-molaritet på [Na +] + [Glucose] /18 + [BUN] /2.8, hvor [Na +], [Glucose] og [BUN] angiver de respektive koncentrationer af disse opløste stoffer i standardenheder af mmol /L.
Beregn plasmasmolariteten fra plasmamolariteten opnået i trin 3, [Na +] + [Glucose] /18 + [BUN] /2,8. At konvertere til osmolaritet multiplicere molaritetsværdierne ved antallet af partikler, som hver af disse opløste stoffer dissocierer ind i. Na + dissocieres i to partikler, mens glucose og BUN hver dissocieres i en partikel. Således er osmolariteten 2 [Na +] + [Glucose] /18 + [BUN] /2.8.
Brug standardreferenceværdier til beregning af osmolaritet i plasma. Standard Na + -koncentrationen er 140 millimol /liter (mmol /L), standardglucosekoncentrationen er 150 milligram /deciliter (mg /dl), og standard BUN-koncentrationen er 20 mg /dl. Fra ligningen 2 [Na +] + [Glucose] /18 + [BUN] /2.8 i trin 4 har vi 2 (140) + (150/18) + (20 /2,8) = 280 + 8,3 + 7,1 = 295. En typisk plasma-osmolaritet er derfor ca. 295 mmol /L.
Sidste artikelSådan læser du en gradueret cylinder
Næste artikelRocket School Projects
 Varme artikler
Varme artikler
-
 Hvordan måler jeg Ocean Wave Energy?Havbølger har en stærk indflydelse på både livet i havet og planetens klima. Vinden danner bølger, der let bevæger sig over vandoverfladen og skifter hastighed, frekvens og dybde afhængigt af vinds
Hvordan måler jeg Ocean Wave Energy?Havbølger har en stærk indflydelse på både livet i havet og planetens klima. Vinden danner bølger, der let bevæger sig over vandoverfladen og skifter hastighed, frekvens og dybde afhængigt af vinds -
 Sådan konverteres nanometre til JoulesNanometre måler længden på meget små størrelser, f.eks. Bølgelængder. En joule, forkortet som J, er en energienhed i det metriske system. Konverteringen mellem nanometer og joule er vigtig i fysik, fo
Sådan konverteres nanometre til JoulesNanometre måler længden på meget små størrelser, f.eks. Bølgelængder. En joule, forkortet som J, er en energienhed i det metriske system. Konverteringen mellem nanometer og joule er vigtig i fysik, fo -
 Afstander fra planeterne fra solen i lysårDet kan være vanskeligt at forstå, hvor enormt solsystemet er. I hjertet af dette system er solen, stjernen, som alle planeter kredser rundt om. Selvom disse planeter synes umuligt langt væk, er viden
Afstander fra planeterne fra solen i lysårDet kan være vanskeligt at forstå, hvor enormt solsystemet er. I hjertet af dette system er solen, stjernen, som alle planeter kredser rundt om. Selvom disse planeter synes umuligt langt væk, er viden -
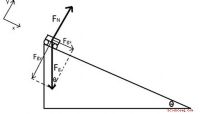 Nettokraft: definition, ligning, hvordan man beregnernettokraften er vektorsummen af alle kræfter, der virker på et legeme. (Husk, at en kraft er et tryk eller et træk.) SI-enheden for kraft er Newton (N), hvor 1 N \u003d 1 kgm /s 2. \\ bold {F
Nettokraft: definition, ligning, hvordan man beregnernettokraften er vektorsummen af alle kræfter, der virker på et legeme. (Husk, at en kraft er et tryk eller et træk.) SI-enheden for kraft er Newton (N), hvor 1 N \u003d 1 kgm /s 2. \\ bold {F


