Hvad er en relativ styrke af kræfter, der holder partiklerne sammen i fast stof?
Kovalent binding:
Ved kovalent binding deler atomer elektroner for at danne stabile molekyler. Styrken af den kovalente binding afhænger af antallet af delte elektroner og elektronegativiteten af de involverede atomer. Kovalente bindinger er typisk stærke og kan resultere i faste stoffer, der er hårde, sprøde og har høje smeltepunkter. Eksempler omfatter diamant (carbon-carbon kovalent binding) og siliciumcarbid (silicium-carbon kovalent binding).
Ionisk binding:
Ved ionbinding donerer et atom elektroner til et andet atom, hvilket resulterer i dannelsen af positivt ladede ioner (kationer) og negativt ladede ioner (anioner). Styrken af ionbindingen afhænger af ladningen af ionerne og afstanden mellem dem. Ionbindinger er typisk stærke og kan producere faste stoffer, der er hårde, sprøde og har høje smeltepunkter. Eksempler omfatter natriumchlorid (NaCl) og calciumoxid (CaO).
Metallisk binding:
Ved metallisk binding er metalatomernes yderste elektroner delokaliseret og kan bevæge sig frit gennem hele metalgitteret. Dette skaber et "hav" af elektroner, der holder de positivt ladede metalioner sammen. Metalliske bindinger er typisk stærke og kan give metaller deres karakteristiske egenskaber såsom høj elektrisk og termisk ledningsevne, formbarhed og duktilitet. Eksempler omfatter kobber, aluminium og stål.
Generelt kan den relative styrke af kræfter, der holder partiklerne sammen i et fast stof, rangeres som kovalent binding> ionbinding> metallisk binding. Men den faktiske styrke af kræfterne afhænger også af de specifikke atomer eller molekyler, der er involveret, og krystalstrukturen af det faste stof.
 Varme artikler
Varme artikler
-
 4-D kamera kan forbedre robot vision, virtual reality og selvkørende bilerTo 138-graders lysfeltpanoramaer (øverst og i midten) og et dybdeestimat af det andet panorama (nederst). Kredit:Stanford Computational Imaging Lab og Photonic Systems Integration Laboratory ved UC Sa
4-D kamera kan forbedre robot vision, virtual reality og selvkørende bilerTo 138-graders lysfeltpanoramaer (øverst og i midten) og et dybdeestimat af det andet panorama (nederst). Kredit:Stanford Computational Imaging Lab og Photonic Systems Integration Laboratory ved UC Sa -
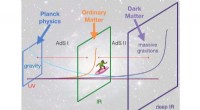 Kunne massive gravitioner være levedygtige kandidater til mørkt stof?Tegneserie af den skæve ekstradimensionelle model, hvor positionen langs den ekstra rumretning er repræsenteret af den vandrette akse. Den almindelige rumtid er repræsenteret af de ortogonale skærme.
Kunne massive gravitioner være levedygtige kandidater til mørkt stof?Tegneserie af den skæve ekstradimensionelle model, hvor positionen langs den ekstra rumretning er repræsenteret af den vandrette akse. Den almindelige rumtid er repræsenteret af de ortogonale skærme. -
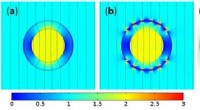 Usynlige magnetiske sensorer måler magnetfelter uden at forstyrre demSimulering af en sfærisk skal, der annullerer forvrængninger forårsaget af en ferromagnetisk kugle, gør kuglen usynlig (magnetisk uopdagelig) udefra. Kredit:Mach-Batlle et al. © 2018 American Institut
Usynlige magnetiske sensorer måler magnetfelter uden at forstyrre demSimulering af en sfærisk skal, der annullerer forvrængninger forårsaget af en ferromagnetisk kugle, gør kuglen usynlig (magnetisk uopdagelig) udefra. Kredit:Mach-Batlle et al. © 2018 American Institut -
 Hvordan molekylære fodbolde brister i en røntgenlaserComputersimuleret udvikling af et C60 -molekyle ved 0, 60 og 240 femto sekunder efter røntgenblitzen. Kredit:DESY, Zoltan Jurek Et internationalt forskerhold har i realtid observeret, hvordan fodb
Hvordan molekylære fodbolde brister i en røntgenlaserComputersimuleret udvikling af et C60 -molekyle ved 0, 60 og 240 femto sekunder efter røntgenblitzen. Kredit:DESY, Zoltan Jurek Et internationalt forskerhold har i realtid observeret, hvordan fodb


