Proteiner, der kan tage varmen
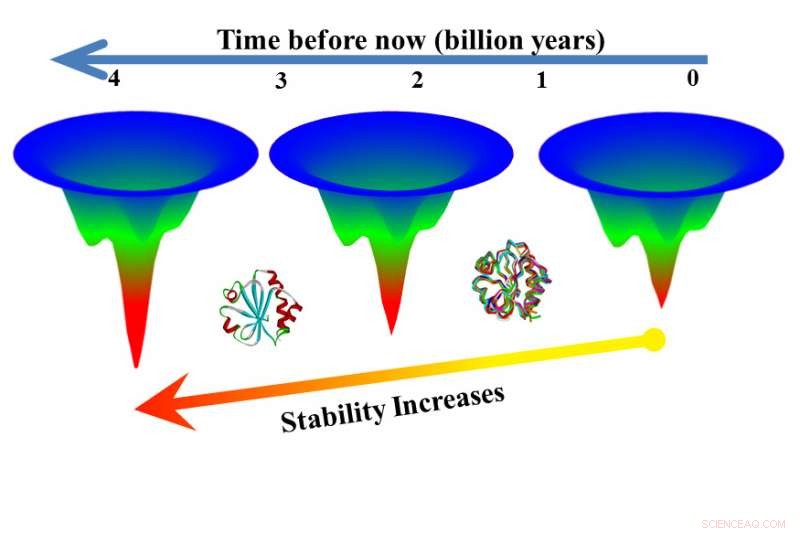
Gamle proteiner kan tilbyde spor om konstruktionsproteiner til at modstå høje temperaturer, der kræves i industrielle applikationer. Kredit:Rensselaer Polytechnic Institute
Gamle proteiner kan give fingerpeg om, hvordan man konstruerer proteiner, der kan modstå de høje temperaturer, der kræves i industrielle applikationer, ifølge ny forskning offentliggjort i Procedurer fra National Academy of Sciences . Forskere brugte eksperimenter til at undersøge kritiske forskelle mellem 15 proteiner fra thioredoxinfamilien, herunder syv uddøde proteinsekvenser, der stammer mere end 4 milliarder år tilbage og blev genoplivet ved hjælp af forfædresekvensrekonstruktioner.
"I industrielle applikationer, proteiner kunne udføre nogle af kemikaliernes arbejde med mindre energi og mindre toksicitet, men de skal kunne modstå de højere temperaturer ved industrielle processer, "sagde George Makhatadze, en konstellationsprofessor i biocomputation og bioinformatik og medlem af Center for Bioteknologi og Tværfaglige Studier ved Rensselaer Polytechnic Institute. "Denne forskning tyder på, at forfædres genopbygningsmetoder kan bruges til at designe proteiner, der udfolder sig langsommere, tilbyder større nytteværdi, ved højere temperaturer. "
Eksperimenterne viste, at forskellen i stabilitet mellem proteiner fra den samme familie primært skyldes forskelle i energien, der kræves for at udfolde proteinerne, et fund, der opretholder en længe vendt teori kendt som "princippet om minimal frustration, "foreslået af fysikere for omkring 30 år siden.
Proteiner er molekylære kæder, hvor hvert led er en af 20 aminosyrer. Når kæden er samlet, forskellige kræfter langs dens længde interagerer, får strengen til at vride og dreje, og i sidste ende foldes ind i en tredimensionel form. Proteinet kan kun udføre sin funktion, når det er korrekt foldet. De fleste proteiner forbliver foldede inden for et bestemt temperaturområde, pH, eller trykforhold, nedbrydes, når de udsættes for forhold uden for disse tolerancer.
Ikke alle regler, der regulerer proteinfoldning, kendes, og Makhatadze ønskede at forstå, hvordan proteiner inden for samme familie, med lignende struktur, er i stand til at udføre den samme livsholdende funktion i vidt forskellige termiske miljøer. Thioredoxiner, for eksempel, findes i alle organismer, fra dem, der bor tæt på kogende hydrotermiske ventilationsåbninger til iskolde arktiske farvande.
En kendt regel hjælper med at forklare, hvorfor der er et astronomisk antal sekvenser mulige for proteiner med hundredvis og endda tusinder af links, men kun en lille delmængde af de mulige sekvenser findes i naturen. Denne regel, princippet om minimal frustration, antager, at naturen kun vælger de sekvenser, der foldes mest effektivt, reducere uønskede interaktioner mellem aminosyrer og producere hurtigere, mindre frustreret, foldemønstre.
For at være i overensstemmelse med princippet om minimal frustration, Makhatadze sagde, proteiner med lignende struktur, men forskellig termodynamisk stabilitet bør foldes langs det samme effektive mønster, men dem med større evne til at tolerere varme bør tage længere tid at udfolde sig. Eksperimenter, først foretaget med otte moderne thioredoxiner, viste hypotesen korrekt.
"Vi testede foldningshastighederne blandt thioredoxiner, en familie af proteiner, der udfører den samme funktion, men - fordi de fungerer under forskellige termiske forhold - skal være forskellige med hensyn til termodynamik, "sagde Makhatadze." Og hvad vi observerede er, at for disse proteiner, de foldes faktisk med den samme hastighed, men de udfolder sig med en anden hastighed - hvilket er, hvad vi forudsagde. "
I det næste trin, forskere testede uddøde versioner af thioredoxiner, der var opnået ved hjælp af en teknik kaldet forfædresekvensrekonstruktion. De uddøde versioner udfoldede sig langsommere end moderne versioner, i nogle tilfælde foldning 3, 000 gange langsommere end en moderne pendant.
"Her har vi to versioner af et protein fra samme familie og en udfoldet på syv sekunder, den anden på seks timer, "Makhatadze sagde." Det betyder, at du kan få nyttig funktion fra proteinet i seks timer mod syv sekunder. Dette viser, at rekonstruktion af forfædresekvens kan være en vej til proteiner, der er mere stabile ved høje temperaturer. "
Fundet understøttes af tidligere offentliggjort forskning og geokemiske data, der indikerer, at Jorden og dens oceaner var varmere i den gamle fortid.
"Tidligere forskning understøtter konstateringen af, at ældre proteiner er mere stabile, men denne nye forskning viser, at disse gamle proteiner er mere stabile, fordi de udfolder sig langsommere, "Sagde Makhatadze.
"Bevis for princippet om minimal frustration i udviklingen af proteinfoldende landskaber" kan findes ved hjælp af den digitale objektidentifikator DOI:10.1073/pnas.1613892114. Forskningen blev støttet af National Science Foundation. Makhatadze blev tilsluttet i forskningen af Fanco Tzul, en postdoc -forsker, og kandidatstuderende Daniel Vasilchuk.
Makhatadzes forskning er muliggjort af visionen om The New Polytechnic, et spirende paradigme for videregående uddannelser, der erkender, at globale udfordringer og muligheder er så store, at de ikke kan løses tilstrækkeligt af selv den mest talentfulde person, der arbejder alene. Rensselaer fungerer som en skillevej for samarbejde - arbejder med partnere på tværs af discipliner, sektorer, og geografiske regioner - for at løse komplekse globale udfordringer, ved hjælp af de mest avancerede værktøjer og teknologier, hvoraf mange er udviklet på Rensselaer. Forskning på Rensselaer omhandler nogle af verdens mest presserende teknologiske udfordringer - fra energisikkerhed og bæredygtig udvikling til bioteknologi og menneskers sundhed. The New Polytechnic er transformerende i den globale virkning af forskning, i sin innovative pædagogik, og i livet for studerende på Rensselaer.
 Varme artikler
Varme artikler
-
 Tetraedre kan forklare vandets unikke karakterForskere ved University of Tokyo bruger en to-statsmodel baseret på dannelsen af tetraedriske strukturer til at forklare vands unormale egenskaber og den overraskende væske-væske-overgang af vand. K
Tetraedre kan forklare vandets unikke karakterForskere ved University of Tokyo bruger en to-statsmodel baseret på dannelsen af tetraedriske strukturer til at forklare vands unormale egenskaber og den overraskende væske-væske-overgang af vand. K -
 Hydrogel 3-D udskrivning og mønster af væsker med kondensatorkanteffekten (PLEEC)Princippet om PLEEC. En asymmetrisk kondensator er adskilt af et dielektrisk lag. Kredit:Science Advances, doi:10.1126/sciadv.aau8769 Hydrogeler er tredimensionelle (3-D) polymernetværk, der kan t
Hydrogel 3-D udskrivning og mønster af væsker med kondensatorkanteffekten (PLEEC)Princippet om PLEEC. En asymmetrisk kondensator er adskilt af et dielektrisk lag. Kredit:Science Advances, doi:10.1126/sciadv.aau8769 Hydrogeler er tredimensionelle (3-D) polymernetværk, der kan t -
 Hvordan folder cellemaskiner fejlfoldede proteiner ud?Kredit:Leiden University Proteinkæder foldes typisk for at fungere. Foldning er en kompleks proces, og hvis det gøres korrekt, fører det til en unik funktionel foldetopologi for en given proteinkæ
Hvordan folder cellemaskiner fejlfoldede proteiner ud?Kredit:Leiden University Proteinkæder foldes typisk for at fungere. Foldning er en kompleks proces, og hvis det gøres korrekt, fører det til en unik funktionel foldetopologi for en given proteinkæ -
 Selvbærende sløjfe af kemiske reaktioner kan revolutionere lægemiddelproduktionenEksperter fra University of Nottingham har skabt et selvbærende kredsløb af reaktioner, som er en grønnere og mere effektiv metode til kemisk produktion. offentliggjort i Nature Catalysis, Drs. France
Selvbærende sløjfe af kemiske reaktioner kan revolutionere lægemiddelproduktionenEksperter fra University of Nottingham har skabt et selvbærende kredsløb af reaktioner, som er en grønnere og mere effektiv metode til kemisk produktion. offentliggjort i Nature Catalysis, Drs. France
- Biokemikere afslører molekylær mekanisme til motorisk proteinregulering
- Korrekt grobund for germanene
- Er solpaneler levedygtige i Stillehavet nordvest?
- De tilsyneladende umærkelige krystaller, der kunne hjælpe med at forudsige vulkanudbrud
- Forsøg på rengøring af pennier
- Forskere rapporterer længe skjulte egenskaber ved Polaris


