Undersøgelsen er rettet mod LigM for dets rolle i nedbrydning af aromatiske forurenende stoffer
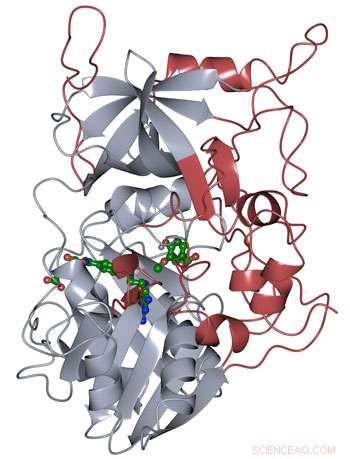
Proteinstrukturen af LigM blev bestemt ved hjælp af røntgenkrystallografi, afslører nye strukturelle elementer, der er unikke for LigM (rød) foruden et konserveret tetrahydrofolat-bindende domæne (grå), der findes gennem hele livet. LigM binder sig til dets underlag (grønt) ved hjælp af interne bindingshulrum. Kredit:Amanda Kohler/JBEI
Et protein, der bruges af almindelige jordbakterier, giver nye spor i bestræbelserne på at omdanne arylforbindelser, et almindeligt affaldsprodukt fra industri- og landbrugspraksis, til noget af værdi.
Forskere ved Department of Energy's Lawrence Berkeley National Laboratory (Berkeley Lab) og Sandia National Laboratories, der arbejder ved Joint BioEnergy Institute (JBEI), har løst proteinstrukturen af enzymet LigM, som bruges af jordbakterien Sphingomonas til at metabolisere arylforbindelser afledt af lignin, den stive, organisk materiale, der giver planter deres struktur.
Deres arbejde er rapporteret i dag i Proceedings of the National Academy of Sciences .
I produktionen af biobrændstoffer, arylforbindelser er et biprodukt af nedbrydningen af lignin. Mange af de veje, der fører til nedbrydning af lignin, involverer demethylering, som ofte er en kritisk forløber for eventuelle yderligere trin i modificering af lignin-afledte arylforbindelser.
Studielederforfatter Amanda Kohler, JBEI postdoc forsker ved Sandia, bemærkede, at LigM er en attraktiv demethylase til brug i aromatisk omdannelse, fordi det er en simpel, enkelt-enzym system. LigM er også i stand til at bevare sin funktionalitet over et bredt temperaturområde.
"Når vi forsøger at bygge nye veje inden for syntetisk biologi, jo enklere system jo bedre, sagde Kohler.

Postdoc-forsker Amanda Kohler opsætter enzymreaktioner som en del af JBEIs Enzyme Optimization Group. Kredit:Marilyn Chung/Berkeley Lab
Forskerne fandt ud af, at halvdelen af LigM-enzymet var homologt med kendte strukturer med et tetrahydrofolatbindende domæne, der findes i både simple og komplekse organismer. Den anden halvdel af LigMs struktur er helt unik, tilvejebringelse af et udgangspunkt for at bestemme, hvor dets arylsubstratbindingssted er placeret. De fandt også ud af, at LigM er en tyrosinafhængig demethylase.
"Det er den første af sin slags, der bliver identificeret, " sagde Kohler. "Denne forskning giver det hårdt tiltrængte grundlag for at hjælpe med udviklingen af et enzymbaseret system til at omdanne aromatiske affaldsprodukter til noget nyttigt."
Kohler sagde, at de nu arbejder på at udvikle LigM, så det er i stand til at handle på en bredere vifte af arylsubstrater ud over at målrette mod specifikke arylaffaldsprodukter.
 Varme artikler
Varme artikler
-
 Vand kan modulere aktiviteten og selektiviteten af reduktion af kuldioxidDet skematiske diagram over vandeffekt på CO 2 hydrogenering over trinvis Cu (211) overflade. Kredit:Science China Press Som et alternativ til udtømning af fossile ressourcer, reduktion af CO 2
Vand kan modulere aktiviteten og selektiviteten af reduktion af kuldioxidDet skematiske diagram over vandeffekt på CO 2 hydrogenering over trinvis Cu (211) overflade. Kredit:Science China Press Som et alternativ til udtømning af fossile ressourcer, reduktion af CO 2 -
 Neutronundersøgelse af glaukomlægemidler giver fingerpeg om enzymmål for aggressive kræftformerDet aktive sted for hCA II. Det aktive sted er flankeret af hydrofile (violette) og hydrofobe (grønne) bindingslommer, der kan bruges til at designe specifikke lægemidler rettet mod cancer-associerede
Neutronundersøgelse af glaukomlægemidler giver fingerpeg om enzymmål for aggressive kræftformerDet aktive sted for hCA II. Det aktive sted er flankeret af hydrofile (violette) og hydrofobe (grønne) bindingslommer, der kan bruges til at designe specifikke lægemidler rettet mod cancer-associerede -
 Udnyttelse af reversibel opløselighed giver mulighed for direkte, optisk mønster af hidtil uset sm…Tynde film af halvledende polymerer blev fremstillet med en overflade-initieret vækst, resulterer i en unik molekylær organisation. Polymerkæder voksede fra overfladen og foldede derefter for at danne
Udnyttelse af reversibel opløselighed giver mulighed for direkte, optisk mønster af hidtil uset sm…Tynde film af halvledende polymerer blev fremstillet med en overflade-initieret vækst, resulterer i en unik molekylær organisation. Polymerkæder voksede fra overfladen og foldede derefter for at danne -
 Lyser vejen til forbedrede biomaterialerKredit:Sleiman Lab Forskere fra McGill University mener, at de har fundet en måde at forbedre udviklingen af biomaterialer, der kunne være medvirkende til lægemiddellevering, vævsregenerering, n
Lyser vejen til forbedrede biomaterialerKredit:Sleiman Lab Forskere fra McGill University mener, at de har fundet en måde at forbedre udviklingen af biomaterialer, der kunne være medvirkende til lægemiddellevering, vævsregenerering, n
- Living Cell Characteristics
- Hvorfor nogle lokale virksomheder kommer bedre igennem COVID-19 end andre
- Flydende svovl ændrer form og bliver kritisk under tryk
- NASA leverer data om den tropiske storm Isaias, da den dækker den østlige kyst
- Tricks til Factoring Trinomials
- Hamborg er den første tyske by, der beordrer dieselforbud


