Neutroner observerer vitamin B6-afhængig enzymaktivitet, der er nyttig til lægemiddeludvikling
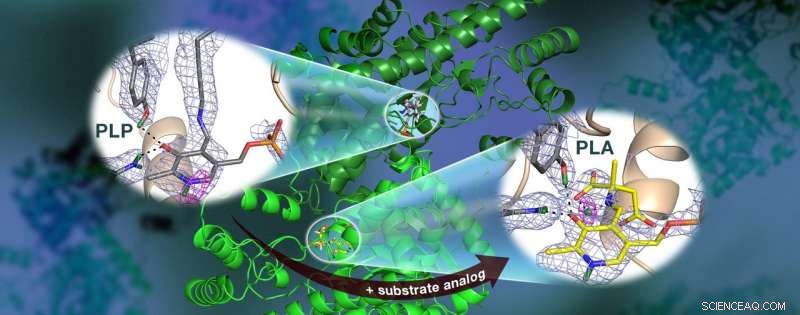
Et ORNL-ledet team brugte neutroner til at observere AAT-enzymet, et vitamin B6-afhængigt protein, og fandt ud af, at den kemiske reaktion kun fandt sted på ét aktivt sted. Nuklear spredningslængde tæthedskort (farvet mesh) fremhæver positionerne af kritiske brintatomer, herunder en lavbarriere hydrogenbinding (magenta mesh), der ikke menes at eksistere i AAT, som kan være afgørende for katalyse. Kredit:Jill Hemman og Andrey Kovalevsky / Oak Ridge National Laboratory, US Department of Energy
Forskere ved Department of Energy's Oak Ridge National Laboratory har udført neutronstrukturanalyse af et vitamin B6-afhængigt protein, potentielt åbne veje for nye antibiotika og lægemidler til at bekæmpe sygdomme som lægemiddelresistent tuberkulose, malaria og diabetes.
Specifikt, holdet brugte neutronkrystallografi til at studere placeringen af hydrogenatomer i aspartataminotransferase, eller AAT, et enzym afgørende for metabolismen af visse aminosyrer.
"Vi visualiserede den første neutronstruktur af et vitamin B6-enzym, der tilhører en stor proteinfamilie med hundredvis af medlemmer, der findes i naturen, " sagde ORNLs Andrey Kovalevsky, en senior medforfatter af undersøgelsen, som blev offentliggjort i Nature Communications.
Vitamin B6-afhængige proteiner er en del af en mangfoldig gruppe af enzymer, der udfører over hundrede forskellige kemiske reaktioner i celler. Enzymerne er af interesse for biomedicinske, samt bioenergi, forskere på grund af deres rolle i metaboliseringen af aminosyrer og andre cellenæringsstoffer.
"Disse enzymer er unikke ved, at hver enkelt udfører en specifik kemisk reaktion med udsøgt nøjagtighed, samtidig med at andre levedygtige kemiske transformationer undertrykkes, " sagde Kovalevsky. "Hvordan de opnår dette er ikke godt forstået, men det er af stor betydning for lægemiddeldesign."
Holdets tidligere forskning forudsagde, at brintatomer bevæger sig ind i og omkring enzymets aktive sted, hvor den kemiske reaktion finder sted, hvilket indikerer, at brintatomernes placering styrer reaktionstypen. At kende den præcise placering af brintatomer kan forklare, hvorfor disse enzymers opførsel er så specifik, men brint er svært at påvise med standardmetoder såsom røntgenkrystallografi.
For direkte at bestemme positionerne af brintatomer i AAT, det ORNL-ledede team henvendte sig til neutrondiffraktionsteknikker. Forskerne eksponerede sarte proteinkrystaller for neutroner ved hjælp af IMAGINE-strålelinjen ved ORNL's High Flux Isotope Reactor og LADI-III-strålelinjen ved Institut Laue-Langevin i Grenoble, Frankrig.
Overraskende nok, holdet observerede en reaktion inden for et AAT-proteinbiomolekyle, mens et andet AAT-biomolekyle var uændret, giver et før-og-efter-perspektiv af den enzym-katalyserede kemiske reaktion.

ORNL's Steven Dajnowicz (til venstre) og Andrey Kovalevsky forberedte en prøve for at begynde neutronstrukturanalyse af et vitamin B6-afhængigt protein ved hjælp af IMAGINE-strålelinjen ved ORNL's High Flux Isotope Reactor. Resultaterne af undersøgelsen kan åbne veje for nye antibiotika og lægemidler til at bekæmpe sygdomme. Kredit:Genevieve Martin/Oak Ridge National Laboratory, US Department of Energy
"Dataene afslørede, at i en af enzymets biomolekylære strukturer reorganiserede de kovalente bindinger sig efter en kemisk reaktion fandt sted i det aktive sted og, i en anden, reaktionen havde ikke fundet sted, " sagde Kovalevsky. "I bund og grund, vi var i stand til at opnå to strukturer i en krystal, hvilket aldrig er blevet gjort før for noget protein, der bruger neutroner."
Med denne viden, holdet vil køre molekylære simuleringer for at bestemme brintatomernes specifikke adfærd, når de interagerer med enzymet. Resultaterne kan være nyttige som vejledning i det fremtidige design af nye lægemidler mod multiresistent tuberkulose, malaria, diabetes og antibiotika-resistente bakterier.
"Denne undersøgelse fremhæver, hvordan neutroner er en uovertruffen sonde til at identificere placeringen af brintatomer i biologiske systemer, giver os et hidtil uset niveau af strukturelle detaljer for dette vigtige enzym, " sagde LADI-III-strålelinjeforsker Matthew Blakeley.
Sidste artikelForskere giver indsigt i letvægtsmateriale, der udvider sig med varme
Næste artikelEn ny måde at teste kropspanser på
 Varme artikler
Varme artikler
-
 Nye kemiske forbindelser gør katalysatorer mere effektiveForskergruppen fra Bochum:Thorsten Scherpf, Viktoria Daeschlein-Gessner, Lennart Scharf og Christopher Schwarz (fra venstre). Kredit:RUB, Marquard Et team fra Chair of Inorganic Chemistry II ved R
Nye kemiske forbindelser gør katalysatorer mere effektiveForskergruppen fra Bochum:Thorsten Scherpf, Viktoria Daeschlein-Gessner, Lennart Scharf og Christopher Schwarz (fra venstre). Kredit:RUB, Marquard Et team fra Chair of Inorganic Chemistry II ved R -
 Forskere skræddersyr hurtig og effektiv N-phosphopeptides berigelsesstrategiBis (zink (II) -dipicolylamin) -funktionaliseret sub-2 μm core-shell mikrosfærer til analyse af N-phosphoproteom. Kredit:JIANG Bo og HU Yechen Protein N-phosphorylering spiller en kritisk rolle i
Forskere skræddersyr hurtig og effektiv N-phosphopeptides berigelsesstrategiBis (zink (II) -dipicolylamin) -funktionaliseret sub-2 μm core-shell mikrosfærer til analyse af N-phosphoproteom. Kredit:JIANG Bo og HU Yechen Protein N-phosphorylering spiller en kritisk rolle i -
 Nedbrydningsstatus for moderne polymere museumsartefakter kan klassificeres efter deres lugtKredit:Wiley Åndedrætsanalyse i sygdomsdiagnostik er et lovende forskningsfelt, og fremskridtene inden for instrumentering muliggør nøjagtig påvisning af metabolitter. Men ikke kun patienternes he
Nedbrydningsstatus for moderne polymere museumsartefakter kan klassificeres efter deres lugtKredit:Wiley Åndedrætsanalyse i sygdomsdiagnostik er et lovende forskningsfelt, og fremskridtene inden for instrumentering muliggør nøjagtig påvisning af metabolitter. Men ikke kun patienternes he -
 Titrering af natriumcarbonat med saltsyreDu kan bruge titreringsteknikken til at bestemme koncentrationen af en natriumcarbonatopløsning ved hjælp af en opløsning med en kendt koncentration af saltsyre, eller omvendt. HCI reducerer gradvis
Titrering af natriumcarbonat med saltsyreDu kan bruge titreringsteknikken til at bestemme koncentrationen af en natriumcarbonatopløsning ved hjælp af en opløsning med en kendt koncentration af saltsyre, eller omvendt. HCI reducerer gradvis
- En menneskelignende planlægger, der tillader robotter at nå objekter i rodede miljøer
- Hvid grafen til undsætning:Sekskantede bornitridplader kan hjælpe grafen med at erstatte silicium
- Efter 900 timer i rummet, Robert Curbeam er nu nede på jorden i Raytheon
- Tidsbesparende simulering af afskalning af grafenplader
- Mere præcise nitrogenanbefalinger for majs for at hjælpe landmænd, reducere forureningen
- Forklarer:Hvordan Richard Branson vil ride sin egen raket til rummet


