Chaperoner forbereder bare proteiner til foldning på egen hånd
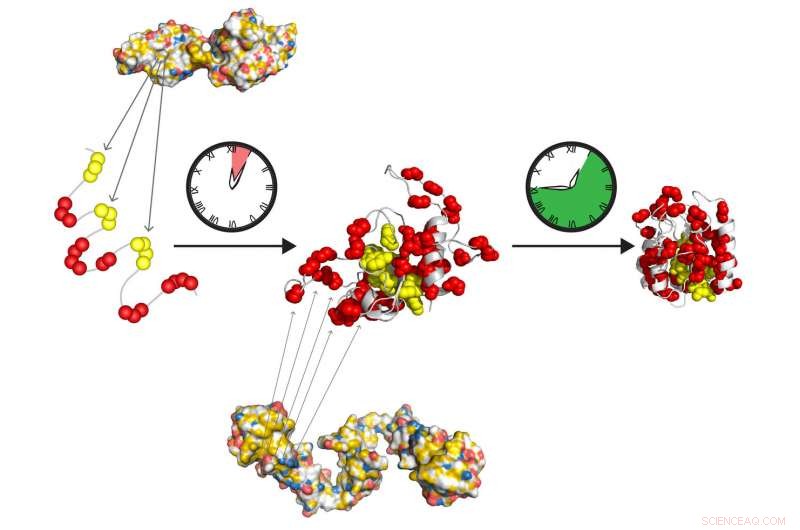
De molekylære chaperoner Hsp70 og Hsp90 danner et hurtigtvirkende relæhold til at forberede proteiner til at folde i deres aktive tilstand på egen hånd. Hsp70 genkender korte hydrofobe strækninger (gul), udsat for det udfoldede protein. Hsp90 virker nedstrøms fra Hsp70 og letter dannelsen af det foldende mellemprodukt, der langsomt går over i den oprindelige tilstand, fri for yderligere chaperone -handling. Kredit:Tania Morán Luengo og Stefan Rüdiger, Utrecht Universitet
Cellulære proteiner produceres som lange kæder af aminosyrer, der skal foldes præcist til deres endelige form. Nøglespillerne i denne foldningsproces er de såkaldte molekylære chaperoner, proteinhjælpere, der sørger for, at denne proces lykkes. Forskere fra Utrecht University, i tæt samarbejde med kolleger fra Heidelberg University, har endelig afsløret, hvordan de to vigtigste chaperonefamilier, Hsp70 og Hsp90, samarbejde i denne foldningsproces. Overraskende, det viser sig, at de ikke aktivt hjælper med foldningen, som forskere længe havde antaget. I stedet, de forbereder simpelthen proteinerne til spontane, produktiv foldning. Dette gennembrud i forståelsen af funktionen af Hsp70-Hsp90-kaskaden vil blive offentliggjort i Molekylær celle den 3. maj.
Forkert foldede proteiner kan resultere i alvorlige sygdomme såsom cystisk fibrose og mange neurodegenerative sygdomme som Alzheimers. Forskere har længe vidst, at Hsp70 og Hsp90 spiller en central rolle i denne foldningsproces, og at Hsp90 virker nedstrøms for Hsp70. Imidlertid, den faktiske mekanisme, hvormed de folder et protein, er forblevet gådefuld.
Ph.d. kandidat Tania Morán Luengo fra Utrecht University har for nylig demonstreret, at chaperonen Hsp70 binder sig til det unge protein, beskytte den og samtidig forhindre den i at folde sig. Derefter bryder Hsp90 Hsp70 -blokken, som gør det muligt for proteinet at fortsætte med at folde sig i den korrekte tilstand af sig selv. Denne opdagelse signalerede den overraskende ende på den mangeårige tro på, at chaperoner folder proteiner.
Forskningsleder Dr. Stefan Rüdiger fra Utrecht University fik et glimt af denne nye idé, mens han forberedte sig på at undervise i et kursus om emnet. Hsp70 binder sig til hydrofobe aminosyrer, beskytte dem mod at hænge sammen, indtil de er skjult inde i den endelige proteinstruktur. Han indså, at måden Hsp70 binder til dets substrater derfor ikke kunne bidrage til proteinfoldning, men snarere hæmmer det i stedet.
Forskerne gik derefter ud for at analysere foldeprocessen, observere, at koncentrationer af Hsp70 i intervallet af dem, der er til stede i vores celler, hæmmede proteinfoldning. "Dette udledte, at Hsp70 ikke er en promotor, men faktisk en effektiv hæmmer af foldeprocessen, "Forklarer Rüdiger. Hans gruppe gik sammen med laboratoriet af prof. Matthias Mayer ved Heidelberg Universitet for at teste denne hypotese eksperimentelt. De demonstrerede, at tilstedeværelsen af Hsp90 på dette tidspunkt er kritisk for, at foldningsprocessen kan forekomme. Hsp90 gør det muligt for proteinet at bryde ud af Hsp70 dødvandet for at folde i sin rigtige form på egen hånd.
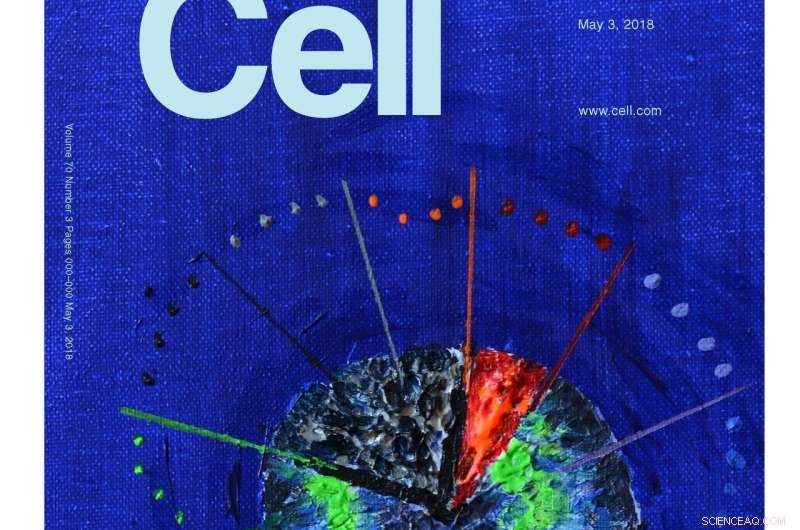
Molecular Cell vælger en illustration af denne forskning til dens omslag. Kunstværket blev udført af forskningsleder Stefan Rüdiger (akryl på lærred). Det repræsenterer, at de konserverede Hsp70 og Hsp90 chaperoner danner en kaskade, der kun er aktiv i den første, rødglødende minutter af foldeprocessen. Den efterfølgende passage gennem stien til den oprindelige tilstand er lang og langsom - og fri for interferens af chaperoner. Kredit:Molecular Cell / Stefan Rüdiger, Utrecht Universitet
"Denne stop-start-mekanisme bevares fra bakterier til mennesker, "Rüdiger siger." Mange sygdomme er afhængige af den endelige aktive form af proteiner. Dermed, forskere, der arbejder med terapier, der er målrettet foldningsprocessen, ved endelig, hvad de skal kigge efter. "
Sidste artikelCellemembran inspirerer til ny ultratynd elektronisk film
Næste artikelHærforsker bruger matematik til at afdække ny kemi
 Varme artikler
Varme artikler
-
 Bakteriefælde kan hjælpe med at bremse antibiotikaresistensKredit:CC0 Public Domain Forskere har udviklet en ny og hurtigere test til at identificere, hvordan enkelte bakterier reagerer på antibiotika, som kunne hjælpe i kampen mod antimikrobiel resistens
Bakteriefælde kan hjælpe med at bremse antibiotikaresistensKredit:CC0 Public Domain Forskere har udviklet en ny og hurtigere test til at identificere, hvordan enkelte bakterier reagerer på antibiotika, som kunne hjælpe i kampen mod antimikrobiel resistens -
 Kemikere opdagede, hvordan hugormegiften virkerKredit:Institut for Bioorganisk Kemi ved Det Russiske Videnskabsakademi Russiske videnskabsmænd rapporterer, at enzymet phospholipase A2 fra Vipera nikolskii-giften er i stand til at klæbe til lip
Kemikere opdagede, hvordan hugormegiften virkerKredit:Institut for Bioorganisk Kemi ved Det Russiske Videnskabsakademi Russiske videnskabsmænd rapporterer, at enzymet phospholipase A2 fra Vipera nikolskii-giften er i stand til at klæbe til lip -
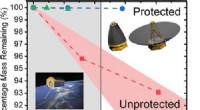 Gennembrudsmateriale kan beskytte satellitter mod ultraviolet stråling og atomært ilt i en bane ud…Kredit:ACS Atomisk ilt dannes, når O 2 molekyler går i stykker, en proces gjort lettere i rummet på grund af overflod af ultraviolet stråling. Ifølge NASA, 96 procent af lav-jordens kredsløbets
Gennembrudsmateriale kan beskytte satellitter mod ultraviolet stråling og atomært ilt i en bane ud…Kredit:ACS Atomisk ilt dannes, når O 2 molekyler går i stykker, en proces gjort lettere i rummet på grund af overflod af ultraviolet stråling. Ifølge NASA, 96 procent af lav-jordens kredsløbets -
 Næste generations opløsningsmidler fanger kulstof med halvdelen af energienPacific Northwest National Laboratory -videnskabsmand David Heldebrant fanger svovl og kuldioxid fra testemissionsstrømme i en proces kaldet Reversible Acid Gas Capture. Kredit:Pacific Northwest Natio
Næste generations opløsningsmidler fanger kulstof med halvdelen af energienPacific Northwest National Laboratory -videnskabsmand David Heldebrant fanger svovl og kuldioxid fra testemissionsstrømme i en proces kaldet Reversible Acid Gas Capture. Kredit:Pacific Northwest Natio
- Økonom:De samfundsmæssige omkostninger ved COVID-19 opvejer individuelle omkostninger
- Enzymaktivitet i Photosynthesis
- Mod udvikling af lægemidler til aldringsrelaterede sygdomme
- ORNL producerer sjælden ruthenium -isotop til atomsprøjtningseksperiment
- Ny forskning viser sammenhæng mellem etnicitet og bias
- Jordskælv fortsatte efter lukning af COVID-19-relaterede olie- og gasindvindinger


