Konstrueret genetisk maskineri afledt af E. coli leverer nye aminosyrer til proteiner
Boston College kemikere har udviklet en ny, bakterie-afledt teknologi til at inkorporere ikke-kanoniske aminosyrer i proteiner fra en bred klasse af organismer, inklusive mennesker. Kredit:Cell Chemical Biology
Proteiner - de molekylære maskiner, der driver de processer, der ligger til grund for biologi - er lavet af kun 20 kanoniske byggesten kaldet aminosyrer. I næsten to årtier, forskere har søgt metoder til at konstruere nye aminosyrer til at bygge proteiner.
Et hold af Boston College kemikere har udviklet en teknologi til præcist at inkorporere en række nyttige ikke-kanoniske aminosyrer i proteiner fremstillet i eukaryoter, den brede klasse af højere organismer, der omfatter mennesker, holdet rapporterede i journalen Cellekemisk biologi .
For cirka 15 år siden, videnskabsmænd så først potentialet i en ingeniør, bakterieafledt genetisk maskineri - kendt som et aminoacyl-tRNA syntetase/tRNA-par - til at inkorporere ikke-kanoniske aminosyrer i proteiner produceret i eukaryote celler. Men metoden har stået over for en række tekniske begrænsninger, der begrænsede dens udbredte udvikling.
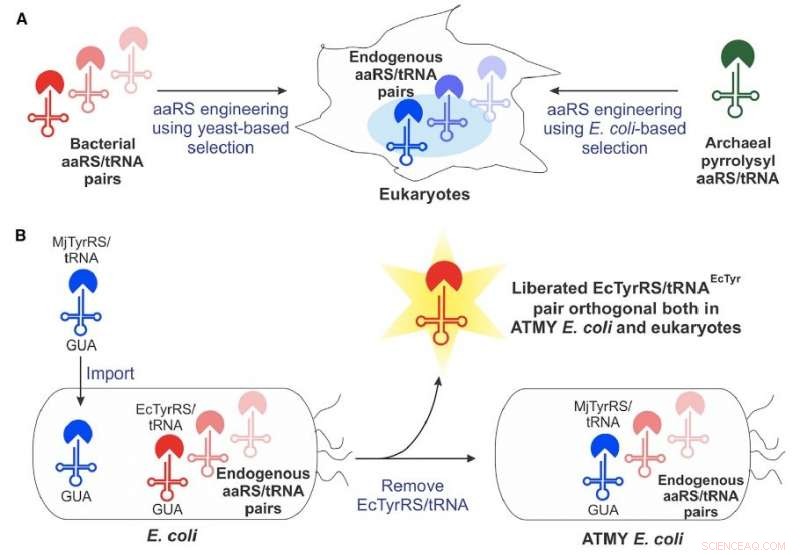
Boston College-teamet overvandt mange af disse begrænsninger ved at udvikle en ny stamme af E. coli bakterier, der muliggør let konstruktion af det bakterie-afledte aminoacyl-tRNA syntetase/tRNA-par, ifølge adjunkt i kemi Abhishek Chatterjee, der ledede projektet. Denne nye tilgang muliggjorde inkorporering af forskellige ikke-kanoniske aminosyrer, herunder p-borophenylalanin, til proteiner produceret i menneskelige celler såvel som i den konstruerede stamme af E coli .
Chatterjee sagde, at holdet var overrasket over faciliteten af den nye tilgang, som er beskrevet i den nye rapport "Genoplive det bakterielle tyrosyl-tRNA synthetase/tRNA-par for at udvide den genetiske kode for begge E coli og eukaryoter."
"At skabe denne roman E coli stamme krævede at erstatte dets native aminoacyl-tRNA-syntetase/tRNA-par med et modstykke fra en anden organisme, hvilket vi forventede ville blive meget vanskeligt, " sagde han. "Men det viste sig at være ret muligt. Det åbner op for denne komplette teknologi."
Chatterjee sagde, at holdet søgte at skabe en ny metode til at konstruere og overvåge proteinfunktioner som en måde at udvide den videnskabelige forståelse af de processer, der styrer proteinfunktioner i vores celler.
"Tusinder af proteiner er kodet i genomet, der gør os til dem, vi er, men vi ved meget lidt om den proces, " sagde Chatterjee. "I menneskelige celler, der er omkring 20, 000 proteinkodende gener. Hvad de laver, og hvordan de gør, er det stadig svært at studere. Et af de største problemer er, at hvis du vil vide, hvad de laver, du er nødt til at udspionere dem. Du skal vedhæfte en sonde, der kan rapportere tilbage om, hvad der foregår."
Det har vist sig vanskeligt at indføre sådanne sonder. da processen ofte skader målproteinet.
I enhver celle, proteiner er lavet af 20 aminosyrer - en fast gruppe, der styres i rækkefølge af genetiske instruktioner.
"Idéen er, at vi kan introducere en ny byggesten i proteiner, som naturen ikke har - ud over de 20 kanoniske aminosyrer, som naturen bruger, " sagde Chatterjee. "Hvis vi kan gøre det, vi har evnen til meget specifikt at introducere en bred vifte af ikke-naturlige funktionaliteter på ethvert sted af stort set ethvert protein."
Den umiddelbare fordel ville være at hjælpe forskere, der stadig er ved at opklare mysterierne omkring cellebiologi og proteinfunktion.
"Du kan skabe et protein med en ikke-kanonisk aminosyre på ethvert valgt sted, indlæs det med sonder, der er meget små og afgiver et optisk signal, der fortæller, hvor det er på vej hen, " sagde Chatterjee. "Det kunne give dig mulighed for at manipulere, hvordan proteinet virker. Du kunne indføre grænser, så uanset hvad proteinet gør, den kan ikke mere. Og du kan fjerne sonden ved at bruge et eksternt signal såsom lys. Denne teknologi åbner op for adskillige nye måder, man kan begynde at undersøge og konstruere proteinfunktion på, hvilket ellers ville være meget udfordrende."
Sidste artikelBlanding af flydende MOF'er producerer nye glasmaterialer
Næste artikelEt periodisk system med molekylære knuder
 Varme artikler
Varme artikler
-
 Ny 3-D-printet teknologi sænker omkostningerne ved almindelig medicinsk testUConn kandidatstuderende Mohamed Sharafeldin, og hans rådgiver, kemi professor James Rusling, udviklet en måde at 3D-printe en pipettespids på. Kredit:Sean Flynn/UConn Photo Et ønske om en enklere
Ny 3-D-printet teknologi sænker omkostningerne ved almindelig medicinsk testUConn kandidatstuderende Mohamed Sharafeldin, og hans rådgiver, kemi professor James Rusling, udviklet en måde at 3D-printe en pipettespids på. Kredit:Sean Flynn/UConn Photo Et ønske om en enklere -
 Sådan narre elektroner til at se krystallers skjulte ansigtEn nylonfiber (lyseblå), aflejret på kulstofbæreren (grå), løfter krystallen op (rød). Denne måde, krystallens sideflade bliver synlig for elektronstrålen (blå). Uden fiberen (højre figur), krystallen
Sådan narre elektroner til at se krystallers skjulte ansigtEn nylonfiber (lyseblå), aflejret på kulstofbæreren (grå), løfter krystallen op (rød). Denne måde, krystallens sideflade bliver synlig for elektronstrålen (blå). Uden fiberen (højre figur), krystallen -
 I eksperimenter på Jorden, afprøve mulige byggesten i fremmed livat udsætte kunstige aminosyrer for ekstreme forhold, forskere jagter efter spor om, hvad der skal til for at overleve på andre planeter. Kredit:Claire Mammoser, Valparaiso Universitet Forskere for
I eksperimenter på Jorden, afprøve mulige byggesten i fremmed livat udsætte kunstige aminosyrer for ekstreme forhold, forskere jagter efter spor om, hvad der skal til for at overleve på andre planeter. Kredit:Claire Mammoser, Valparaiso Universitet Forskere for -
 Massespektrometri kaster nyt lys over thalliumforgiftende cold caseHårprøver fra offeret monteres på objektglas til analyse ved massespektrometri. Kredit:Faye Levine I 1994, Den kinesiske universitetsstuderende Zhu Ling begyndte at opleve mavesmerter, hårtab og d
Massespektrometri kaster nyt lys over thalliumforgiftende cold caseHårprøver fra offeret monteres på objektglas til analyse ved massespektrometri. Kredit:Faye Levine I 1994, Den kinesiske universitetsstuderende Zhu Ling begyndte at opleve mavesmerter, hårtab og d
- Vi stoler på videnskaben. Hvorfor svigter det os, når vi har allermest brug for det?
- NASA ser en stærkere tropisk cyklon 33W på vej mod Vietnam
- Enzymcocktail udviklet i Brasilien driver produktionen af anden generations ethanol
- Hitchhiking nanorør viser hvordan celler omrører sig selv
- Samarbejde giver lovende innovation inden for pletbestandighed
- Rapport:Great Lakes -følelser af hurtig klimaopvarmning (opdatering)


