Forskere skabte proteiner styret af lys
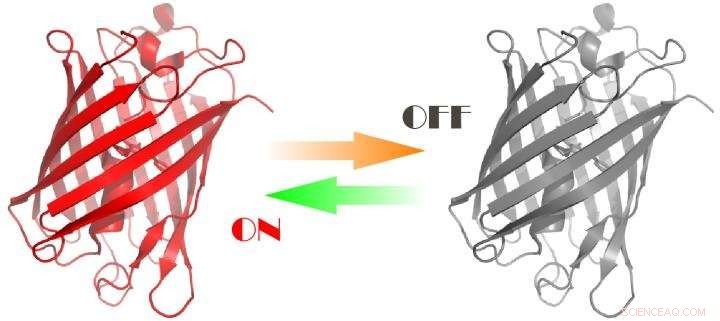
3D-model af det udviklede protein Kredit:Aleksandr Mishin
Forskere har udviklet fluorescerende proteiner, der kan styres af orange og grønt lys. Disse proteiner vil hjælpe med at studere processer i levende celler. Resultaterne blev offentliggjort i Naturens metoder .
Fluorescerende proteiner udsender intenst synligt lys med bølgelængder fra 390 til 700 nm. Naturlige funktioner af sådanne proteiner er forskellige; for eksempel, nogle arter af vandmænd bruger grønne fluorescerende pletter til at tiltrække små organismer, der tjener som føde. Optiske egenskaber af visse fluorescerende proteiner kan kontrolleres med lys. For eksempel, sådanne proteiner kan aktiveres og deaktiveres, og kaldes derfor omskiftelige. Skiftbare fluorescerende proteiner er meget udbredt i en ny gruppe af metoder kaldet super-resolution fluorescensmikroskopi (nanoskopi), som muliggør billeddannelse af ekstremt detaljerede intracellulære strukturer. I øjeblikket, videnskabsmænd bruger normalt blå eller violet bestråling til sådan mikroskopi, hvilket er meget giftigt for celler, da det forstyrrer deres normale fysiologi og kan endda forårsage død.
"Vi var de første til at skabe fotoswitchable fluorescerende proteiner med optiske egenskaber, der kan kontrolleres ved hjælp af grønt og orange lys frem for blåviolet stråling. Fordelen ved dette er minimal skade på celler. Vi brugte nye proteiner til at observere cytoskeletændringer i levende celler. over tid, " forklarede Aleksandr Mishin, Ph.D, seniorforsker ved Shemyakin-Ovchinnikov Institut for Bioorganisk Kemi ved Det Russiske Videnskabsakademi, der stod i spidsen for RSF-projektet.
For at skabe sådanne fluorescerende proteiner, forskerne ændrede dem ved rettet og tilfældig mutagenese via polymerasekædereaktion. Derefter klonede forskerne proteiner og udvalgte de bedst ydende ved hjælp af et mikroskop. Forfatterne analyserede resultaterne af eksperimenter udført af andre biologer og bestemte, hvordan kromoforens mikromiljø (den aromatiske aminosyrerest, der er ansvarlig for lysabsorption i proteinet) skal ændres for at gøre den i stand til at fotoskifte.
Imidlertid, det forventede resultat har bivirkninger, herunder reduceret lysstyrke af proteinet. Forskerne brugte tilfældig mutagenese til at finde yderligere mutationer, som kompenserer for metodens bivirkninger og samtidig bevare målmutationen.
Proteinerne kaldes reporterproteiner, da de fungerer som "spioner" i celler. De er knyttet til andre proteiner, som så kan spores i en levende celle. De derved opnåede detaljerede oplysninger kan bruges i grundvidenskab eller biomedicinsk forskning. For eksempel, tumorceller hos cancerpatienter udviser dramatiske forstyrrelser i cellemobilitet og dynamiske strukturelle ændringer i cytoskelettet, et slagtekrop i cytoplasmaet af en levende celle. I mellemtiden undersøgelse af disse processer i levende celler ved nanoskopi er vanskelig på grund af den alt for intense bestråling af prøver, gør det nødvendigt at bruge metoder, der er mindre giftige for organismen.
Forfatterne brugte deres udvikling til at udføre RESOLFT superopløsningsmikroskopi. Proteinerne har en vigtig egenskab:Deres fotoswitching er meget effektiv, hvilket betyder, at fluorescens kan tændes og slukkes på millisekunder. Dette passer ikke til alle mikroskopimetoder. I nogle tilfælde, den høje hastighed vil kun være til gene. I RESOLFT, tænd-sluk-cyklussen gentages mange gange for tilstødende punkter, der scannes med laserstråler. Jo bedre skiftetiden for et fluorescerende mærke er, jo hurtigere det komplette billede kan opnås, da fotoswitching på hvert punkt kræver mindre tid.
"De fluorescerende proteiner, vi skabte, vil muliggøre superopløsningsmikroskopi uden at skade den levende celle, som åbner muligheder for at studere dynamiske processer i cellen, " konkluderede Aleksandr Mishin.
 Varme artikler
Varme artikler
-
 Forskere ved ESS, Svensk vandforskning, ORNL bruger VISION til at se på almindelige forurenende sto…Brug af neutronspredning, Monika Hartl fra European Spallation Source studerer, hvordan vandfiltre interagerer med forurenende stoffer for at optimere filterdesign og forbedre vandbehandlingsmetoder.
Forskere ved ESS, Svensk vandforskning, ORNL bruger VISION til at se på almindelige forurenende sto…Brug af neutronspredning, Monika Hartl fra European Spallation Source studerer, hvordan vandfiltre interagerer med forurenende stoffer for at optimere filterdesign og forbedre vandbehandlingsmetoder. -
 Bioinspirerede materialer—Graphen-aktiverede nikkelkompositterNi/grafen pulvere efter forskydningsblanding og frysetørring. (A) SEM billede af Ni/grafen pulvere, viser ingen mærkbar aggregering af grafenark. (B) TEM billede af overfladen af et Ni/grafen pulver
Bioinspirerede materialer—Graphen-aktiverede nikkelkompositterNi/grafen pulvere efter forskydningsblanding og frysetørring. (A) SEM billede af Ni/grafen pulvere, viser ingen mærkbar aggregering af grafenark. (B) TEM billede af overfladen af et Ni/grafen pulver -
 Nye maskinlæringsbaserede rammer kan føre til gennembrud inden for materialedesignYaxin An, Sanket A. Deshmukh, og Karteek Bejagam. Kredit:Virginia Tech Computere plejede at optage hele lokaler. I dag, en bærbar computer på to pund kan nemt glide ned i en rygsæk. Men det ville
Nye maskinlæringsbaserede rammer kan føre til gennembrud inden for materialedesignYaxin An, Sanket A. Deshmukh, og Karteek Bejagam. Kredit:Virginia Tech Computere plejede at optage hele lokaler. I dag, en bærbar computer på to pund kan nemt glide ned i en rygsæk. Men det ville -
 Strukturel indsigt i den molekylære mekanisme ved PET -nedbrydningStrukturel indsigt i den molekylære mekanisme ved poly (ethylenterephthalat) nedbrydning og det fylogenetiske træ af mulige PET -nedbrydende enzymer. Kredit:KAIST Et KAIST metabolisk ingeniørunder
Strukturel indsigt i den molekylære mekanisme ved PET -nedbrydningStrukturel indsigt i den molekylære mekanisme ved poly (ethylenterephthalat) nedbrydning og det fylogenetiske træ af mulige PET -nedbrydende enzymer. Kredit:KAIST Et KAIST metabolisk ingeniørunder
- Klimaændringer gør Arktis til strategisk, økonomisk hotspot
- Bleriot XI
- Genoplivende kvasikrystaller:Fund gør et eksotisk materiale kommercielt levedygtigt
- Kasakhisk mand dør i brand efter russisk raketopsendelse:regering.
- Næsten halvdelen af de finske præster har en positiv holdning til dødshjælp
- Sådan beregnes en 10 procents rabat


