Forskere undersøger hydrogenbindinger ved hjælp af ny teknik
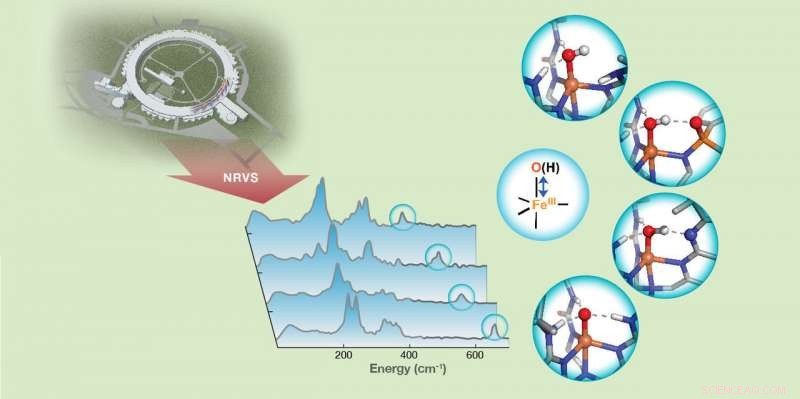
Hydrogenbindingsstyrke til jern(III)-oxido/hydroxido (FeIII-O/OH)-enheder i non-heme jernkomplekser afsløres af FeIII-O/OH-strækningsvibrationer detekteret med 57Fe nuklear resonans vibrationsspektroskopi (NRVS). Kredit:Carnegie Mellon University
Forskere ved Carnegie Mellon University har brugt nuklear resonans vibrationsspektroskopi til at undersøge de hydrogenbindinger, der modulerer den kemiske reaktivitet af enzymer, katalysatorer og biomimetiske komplekser. Teknikken kan føre til udvikling af bedre katalysatorer til brug på en lang række områder. Resultaterne blev offentliggjort som et "Meget vigtigt papir" i 3. december-udgaven af Angewandte Chemie og med på bladets bagside.
Hydrogenbindinger er blandt de mest fundamentale interaktioner, der findes i biologi og kemi. De er ansvarlige for mange af de kemisk vigtige egenskaber ved vand, til at stabilisere strukturerne af proteiner og nukleinsyrer, inklusive dem, der findes i DNA og RNA, og bidrage til strukturen af naturlige og syntetiske polymerer.
Forskning har vist, at hydrogenbindinger spiller en vigtig rolle i tuning af reaktiviteten af metalcentrene i metalloenzymer og metalholdige katalysatorer. Imidlertid, lidt forskning er blevet udført for eksperimentelt at demonstrere, hvordan systematiske ændringer af hydrogenbindinger inden for den sekundære koordinationssfære - molekyler fundet i nærheden af metalcentre, som ikke har direkte bindingsinteraktioner med centret - påvirker katalytisk aktivitet.
I katalyse, enzymer eller syntetiske katalysatorer ansporer til en kæde af kemiske reaktioner, som producerer en række mellemstrukturer eller arter. At forstå disse strukturer og deres kemiske egenskaber er nøglen til at forstå hele reaktionen.
"En grundig forståelse af den kemiske reaktivitet af det reaktive mellemprodukt er et nøgletrin til at bestemme, hvordan man designer højeffektive og selektive katalysatorer til CH-funktionalisering, " sagde Yisong Guo, assisterende professor i kemi ved Carnegie Mellon og undersøgelsens hovedforfatter. "I tilfælde af dioxygen-aktiverende enzymer, de vigtigste mellemprodukter i katalyse er jern-oxo (Fe-O) og jern-hydroxo (Fe-OH) arter, som er involveret i vigtige biologiske processer, såsom DNA-biosyntese, DNA og RNA reparation, post-translationel modifikation af proteiner, biosyntese af antibiotika og nedbrydning af giftige forbindelser."
Guo og kolleger brugte 57Fe nuklear resonans vibrationsspektroskopi (NRVS), en nyudviklet synkrotronstrålingsbaseret teknik, at detektere vibrationsfrekvensen af Fe-O- og Fe-OH-enheder af syntetiske komplekser, der interagerer med den sekundære koordinationssfære gennem hydrogenbindinger. Ændringer i frekvenserne afslørede værdifuld information om bindingsstyrkerne af disse enheder og gav yderligere et kvalitativt mål for hydrogenbindingsstyrke.
"Dette viste, at NRVS er en følsom teknik til at opfange meget små ændringer i hydrogenbindingsstyrke, ned til ændringerne af en enkelt brintbinding. Dette giver os en ny metode til at forbinde ændringer i bindingsstyrke af Fe-O og Fe-OH enheder til deres kemiske reaktivitet, " sagde Guo.
Guo siger, at denne undersøgelse er et proof-of-concept for at bruge NRVS til at undersøge hydrogenbindinger. Han planlægger at fortsætte med at bruge denne metode til at studere flere jern-oxo- og jern-hydroxo-arter i både syntetiske komplekser og enzymer for at opbygge mængden af tilgængelige data for at korrelere kemisk reaktivitet af disse arter med ændringerne af hydrogenbindingsinteraktioner, med håb om, at disse oplysninger kunne bruges til at udvikle mere effektive og effektive katalysatorer.
 Varme artikler
Varme artikler
-
 Pas på andre bakterier, der bærer gaver:Forskning præsenterer nye potentielle antimikrobielle mid…Trojansk hest-strategi Kredit:Pavel Odinev/Skoltech Skoltech -forskere undersøgte de antibiotiske forbindelser, der anvender en trojansk hest -strategi for at komme ind i en bakteriecelle uigenken
Pas på andre bakterier, der bærer gaver:Forskning præsenterer nye potentielle antimikrobielle mid…Trojansk hest-strategi Kredit:Pavel Odinev/Skoltech Skoltech -forskere undersøgte de antibiotiske forbindelser, der anvender en trojansk hest -strategi for at komme ind i en bakteriecelle uigenken -
 Nye biomaterialer kan finjusteres til medicinske anvendelserKredit:Unsplash/CC0 Public Domain Det er lykkedes forskere i Storbritannien og USA at finjustere et nyt termoplastisk biomateriale, så både den hastighed, hvormed det nedbrydes i kroppen, og dets
Nye biomaterialer kan finjusteres til medicinske anvendelserKredit:Unsplash/CC0 Public Domain Det er lykkedes forskere i Storbritannien og USA at finjustere et nyt termoplastisk biomateriale, så både den hastighed, hvormed det nedbrydes i kroppen, og dets -
 Hvad er forskellen mellem blå og rød lakmapapir?Litmus-papir bruges til at teste pH-vægten af en væske eller et stof. De fleste stoffer er enten alkali eller syre. Alkaliske eller basiske kemikalier inkluderer bagepulver, ammoniak og lut. Sure st
Hvad er forskellen mellem blå og rød lakmapapir?Litmus-papir bruges til at teste pH-vægten af en væske eller et stof. De fleste stoffer er enten alkali eller syre. Alkaliske eller basiske kemikalier inkluderer bagepulver, ammoniak og lut. Sure st -
 Kampen mod antibiotika-resistente bakterier har et glødende nyt våbenEn ny kemisk sonde lyser i nærvær af et bakterielt enzym, der bidrager til antibiotikaresistens. Kredit:University of Texas i Austin I det evige våbenkapløb mellem bakterier og menneskeskabte anti
Kampen mod antibiotika-resistente bakterier har et glødende nyt våbenEn ny kemisk sonde lyser i nærvær af et bakterielt enzym, der bidrager til antibiotikaresistens. Kredit:University of Texas i Austin I det evige våbenkapløb mellem bakterier og menneskeskabte anti
- Forskere skaber kunstig virus i kampen mod superbugs
- Ingen gårde, ingen mad
- Nye multikomponentreaktionsgrænser
- At drage omsorg for samfundet for at slå coronavirus afspejler indfødte ideer om et godt liv
- Skrifterne er sjældent en væsentlig motivationsfaktor bag vold, siger forskere
- Vi får hver 7 kvadratmeter dyrket mark om dagen. For meget sprut og pizza får os til at overskride…


