Bakterielt protein kan hjælpe med at finde materialer til din næste smartphone
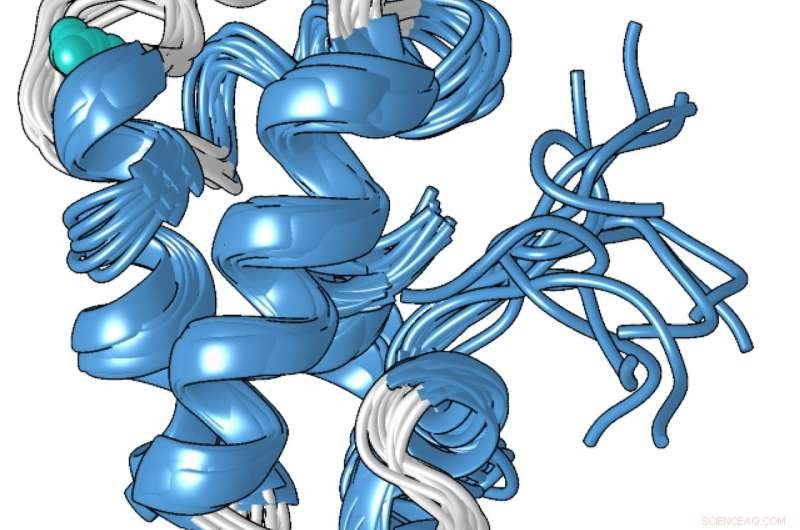
En strukturel model af den kompakte metalbundne form af lanmodulinproteinet, som er 100 millioner gange bedre til at binde sig til lanthanider-de sjældne jordartsmetaller, der bruges i smartphones og andre teknologier-end til andre metaller som calcium. Kredit:Penn State
Et nyopdaget protein kan hjælpe med at opdage, mål, og indsamle de sjældne jordarters metaller, der bruges i smartphones. To nye undersøgelser af forskere ved Penn State beskriver proteinet, som er 100 millioner gange bedre til at binde sig til lanthanider-de sjældne jordartsmetaller, der bruges i smartphones og andre teknologier-end til andre metaller som calcium. Den første undersøgelse, som vises i Journal of the American Chemical Society , beskriver proteinet, og det andet papir, som vises online i journalen Biokemi , beskriver dens unikke struktur, som sandsynligvis spiller en rolle i sin bemærkelsesværdige selektivitet for lanthanider.
"For nylig, der har været stor interesse for at øge tilgængeligheden af sjældne jordarter som lanthanider, som bruges i skærme og elektronik til smartphones, batterier i hybridbiler, lasere, og andre teknologier, "sagde Joseph Cotruvo Jr., adjunkt og Louis Martarano Karriereudviklingsprofessor i kemi ved Penn State og forfatter til begge undersøgelser. "Fordi de fysiske egenskaber ved sjældne jordarter er så ens, det kan være svært at målrette og samle en især. At forstå, hvordan dette protein binder lanthanider med så utrolig høj selektivitet, kan afsløre måder at opdage og målrette mod disse vigtige metaller. "
Forskergruppen opdagede proteinet, som de kaldte lanmodulin, i bakterien Methylobacterium extorquens, som vokser på planteblade og i jord og spiller en vigtig rolle i, hvordan kulstof bevæger sig gennem miljøet. Bakterierne kræver lanthanider for at nogle af deres enzymer fungerer korrekt, herunder en, der hjælper bakterierne med at behandle kulstof, som er nødvendig for dens vækst.
"Disse bakterier har brug for lanthanider og andre metaller som calcium for at vokse, "sagde Cotruvo." De har brug for en måde at få hvert metal fra miljøet og sørge for, at hvert går til det rigtige sted i cellen. Det ser ud til, at disse bakterier har udviklet en unik måde at målrette lanthanider i miljøet, hvor de er meget mindre rigelige end andre metaller som calcium. "
Proteinets unikke struktur, som Cotruvo bestemte i samarbejde med laboratoriet i Scott Showalter, lektor i kemi ved Penn State, kan forklare, hvorfor det er 100 millioner gange bedre til at binde lanthanider over calcium. I mangel af metal, Cotruvo forklarede, proteinet er for det meste ustruktureret, men når metal er til stede, det ændrer konformation til en kompakt, veldefineret struktur.
Den nye kompakte form indeholder fire strukturer kaldet "EF -hænder". Menneskelige celler indeholder mange proteiner med EF -hænder, som er involveret i at bruge calcium til funktioner som neuroner, der brænder og muskler, der trækker sig sammen. Disse proteiner binder også lanthanider, selvom lanthanider ikke er fysiologisk relevante hos mennesker, og proteinerne kun er 10 eller 100 gange mere tilbøjelige til at binde lanthanider, end de er til at binde calcium. Den kompakte struktur af lanmodulinproteinet indeholder også en aminosyre kaldet prolin i en unik position i hver af EF -hænderne, som kan bidrage til proteinets lanthanidselektivitet.
"Mekanismen for lanmodulins selektivitet for lanthanider er endnu ikke klar, men vi tror, det kommer ned på den strukturelle ændring, der sker i nærvær af metaller, "sagde Cotruvo." Denne strukturelle ændring er vigtig for proteinets funktion; for eksempel, nogle protein-protein-interaktioner sker muligvis kun, når proteinet er i sin kompakte form. En meget lille mængde lanthanider er påkrævet for at fremkalde konformationsændringen, men det ville kræve meget mere calcium, mere end bakterierne kan have, for faktisk at foranledige ændringen. Dette ville bidrage til at sikre selektivitet for lanthanider inde i celler. "
At forstå, hvordan proteinet er så selektivt, kan give indsigt i indsamling af lanthanider til industrielle formål, herunder udvinding fra mineaffaldsstrømme.
"At behandle disse vandløb for at adskille sjældne jordarter fra andre metaller på en økonomisk måde er udfordrende, sagde Cotruvo, "både på grund af den lave overflod af de sjældne jordarter og deres uopløselighed, kræver store mængder syre for at holde dem i opløsning. Sænkning af pH sænker typisk affinitet over for metaller, men vi tror, at dette protein starter med så høj affinitet, at det kan hjælpe med at overvinde disse udfordringer. Vi undersøger i øjeblikket denne mulighed. "
Ud over at undersøge proteinets selektivitetsmekanisme og funktionen af de unikt placerede aminosyrer, forskergruppen undersøger også proteinets affinitet til andre metaller, fordi lanthanider ofte findes i nærvær af andre metaller, herunder jern, mangan, og aluminium, der forekommer i større mængder.
"Vi er også meget interesserede i proteinets biologiske funktion, "sagde Cotruvo." Men i sidste ende håber vi, at forståelsen af proteinet vil føre til mere miljøvenlige måder at erhverve sjældne jordartsmetaller fra miljøet. "
 Varme artikler
Varme artikler
-
 Tang:Fra superfood til superlederForskere har skabt porøse æggekasse-strukturerede nanofibre ved hjælp af tangekstrakt. Kredit:American Chemical Society Tang, de spiselige alger med en lang historie i nogle asiatiske køkkener, og
Tang:Fra superfood til superlederForskere har skabt porøse æggekasse-strukturerede nanofibre ved hjælp af tangekstrakt. Kredit:American Chemical Society Tang, de spiselige alger med en lang historie i nogle asiatiske køkkener, og -
 Dæmpning af havplastikKredit:CC0 Public Domain Efterhånden som mennesker i udviklingslandene bliver mere velhavende, de ender med at købe mere plastik. Men disse områder har ofte ikke gode affaldshåndteringsprocedurer
Dæmpning af havplastikKredit:CC0 Public Domain Efterhånden som mennesker i udviklingslandene bliver mere velhavende, de ender med at købe mere plastik. Men disse områder har ofte ikke gode affaldshåndteringsprocedurer -
 Hvad er forskellen mellem lakmuspapir og pH-strips?Kemikalier og opløsninger klassificeres ofte som værende sure, basiske eller neutrale. Disse egenskaber bestemmes af pH-skalaen, der spænder fra 0 til 14. Lave pH-værdier betragtes som sure, høje værd
Hvad er forskellen mellem lakmuspapir og pH-strips?Kemikalier og opløsninger klassificeres ofte som værende sure, basiske eller neutrale. Disse egenskaber bestemmes af pH-skalaen, der spænder fra 0 til 14. Lave pH-værdier betragtes som sure, høje værd -
 Forståelse af, hvordan katalysatorer ældes, kan optimere industriel brugZirui Gao, en forsker ved PSI, har udviklet en ny algoritme til eksperimentelle undersøgelser, der markant forkorter varigheden af visse billeddiagnostiske målinger, der ellers ville tage for lang t
Forståelse af, hvordan katalysatorer ældes, kan optimere industriel brugZirui Gao, en forsker ved PSI, har udviklet en ny algoritme til eksperimentelle undersøgelser, der markant forkorter varigheden af visse billeddiagnostiske målinger, der ellers ville tage for lang t
- Tag et kig ind i en kæmpe stjerne lige før den dør
- Et bæredygtigt svar på industriel forurening? Det er bananer!
- Sådan opbygges en spændingsregulator
- Cambridge Analytica kæmper tilbage på dataskandaler
- Engineering enkelt-molekyle fluorescens med asymmetriske nano-antenner
- Højtydende elektrokatalysatorer til at drive udviklingen af direkte ethanolbrændselsceller


