Ny metode bruger fluorescens til at identificere sygdomsfremkaldende former for proteiner
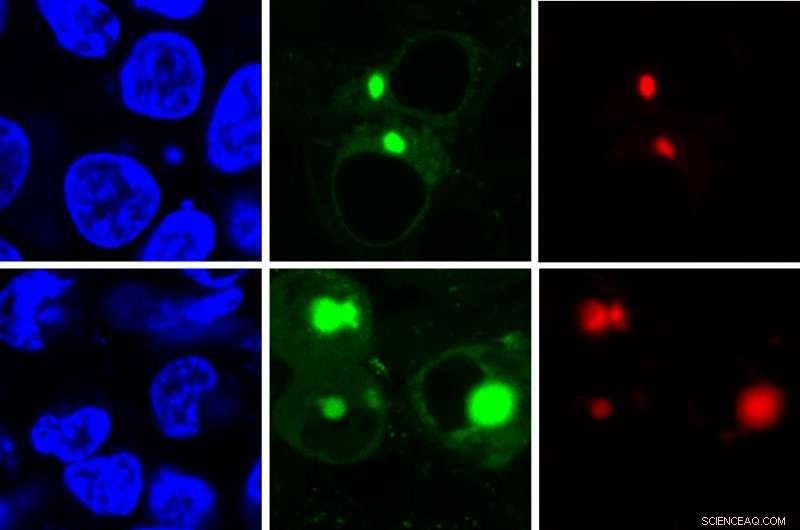
Den nye AggTag-metode giver forskere mulighed for at se de tidligere uopdagelige, men potentielt sygdomsfremkaldende mellemformer af proteiner, når de folder forkert. Metoden bruger fluorescens til samtidig at detektere to forskellige proteiner (rød, grøn) i cellen (blå). Kredit:Zhang Lab, Penn State
En ny metode bruger fluorescens til at detektere potentielt sygdomsfremkaldende former for proteiner, når de optrævler på grund af stress eller mutationer. Et team af forskere fra Penn State og University of Washington omkonstruerede en fluorescerende forbindelse og udviklede en metode til samtidig at lyse to forskellige proteiner op, når de folder forkert og aggregeres inde i en levende celle, fremhæve former, der sandsynligvis spiller en rolle i flere neurodegenerative sygdomme, herunder Alzheimers og Parkinsons. To nyere artikler, der beskriver metoden, vises online i ChemBioChem og Journal of the American Chemical Society .
"For at fungere korrekt, proteiner foldes til meget præcise strukturer, men miljøstress eller patogene mutationer kan få proteiner til at fejlfolde og aggregere, " sagde Xin Zhang, assisterende professor i kemi og i biokemi og molekylærbiologi ved Penn State og leder af forskerholdet. "Proteinaggregering er en proces i flere trin, og det menes, at mellemformen, som tidligere billedbehandlingsteknikker ikke kunne opdage, er ansvarlig for en række sygdomme, herunder Alzheimers, Parkinsons, Type 2 diabetes, og cystisk fibrose. Vi udviklede Aggregation Tag-metoden - AggTag - for at se disse tidligere uopdagelige mellemprodukter - opløselige oligomerer - såvel som de endelige aggregater i levende celler."
Tidligere teknikker til at identificere proteinaggregering brugte fluorescerende forbindelser, der altid var oplyst, hvilket gjorde det umuligt at skelne korrekt foldede proteiner fra mellemformen, fordi begge udløser diffus fluorescens på lavt niveau. AggTag-metoden bruger "tænd fluorescens, så sammensætningen lyser kun, når fejlfoldning begynder at forekomme.
"Når den fluorescerende forbindelse har masser af plads til at bevæge sig, den roterer frit og forbliver slukket, som i nærvær af et korrekt foldet protein, " sagde Yu Liu, assisterende forskningsprofessor i kemi ved Penn State og nøgleudvikleren af AggTag-metoden. "Men når proteinet begynder at folde forkert og aggregere, forbindelsens bevægelse bliver begrænset, og den begynder at lyse op. Diffus fluorescens indikerer, at mellemliggende oligomerer er til stede, mens små punkter med lysere fluorescens indikerer, at de tættere uopløselige aggregater er til stede."
For at tillade denne sondring mellem former, forskerholdet omkonstruerede den farvefremkaldende kerne af det grønne fluorescerende protein (GFP), som er almindeligt anvendt i billeddannelsesundersøgelser, fordi det fluorescerer, når det udsættes for visse bølgelængder af lys. Den ombyggede forbindelse binder til et mærke, som igen smelter sammen til et protein målrettet til billeddannelse.
Forskerholdet brugte to forskellige slags kommercielt tilgængelige tags, Halo-tag og SNAP-tag, som, når det bruges sammen med AggTag, kan inducere rød eller grøn fluorescens, henholdsvis. Fordi Halo-tags og SNAP-tags ikke interagerer med hinanden, de kan bruges til samtidig at afbilde to forskellige proteiner med de to farver. Holdet konstruerede også tags, så de grønne og røde farver kan vendes om, give forskerne muligheder for fremtidig billeddannelse.
"Vi planlægger at fortsætte med at udvikle denne metode, så vi kan signalere overgangen af oligomerer til uopløselige aggregater ved hjælp af en farveændring, " sagde Zhang. "Denne metode giver en ny værktøjskasse til at studere proteinaggregering, som i øjeblikket er et højt undersøgt emne blandt videnskabsmænd. Forhåbentlig vil dette give os mulighed for bedre at forstå hele processen med proteinaggregering og hver af disse formers rolle i udviklingen af neurodegenerative og andre sygdomme."
Sidste artikelPolymerer baner vejen for bredere brug af genbrugsdæk i asfalt
Næste artikelUpcycling af plastikposer til batteridele
 Varme artikler
Varme artikler
-
 Nye cellulosefund kan føre til nye kemikalier, biobrændstofferForskere afslørede den snoede krystalorientering af cellulosefibre, afbilledet her i grønt i cellerne i en løgskal. Kredit:Edward Wagner, Cosgrove Lab, Penn State En multiinstitutionel forskergrup
Nye cellulosefund kan føre til nye kemikalier, biobrændstofferForskere afslørede den snoede krystalorientering af cellulosefibre, afbilledet her i grønt i cellerne i en løgskal. Kredit:Edward Wagner, Cosgrove Lab, Penn State En multiinstitutionel forskergrup -
 En ny måde at kombinere bløde materialer påEn umodificeret hydrogel (til venstre) skræller let af fra en elastomer. En kemisk bundet hydrogel og elastomer (til højre) er svære at skille fra hinanden, efterlader rester efter kredit:Suo Lab/Harv
En ny måde at kombinere bløde materialer påEn umodificeret hydrogel (til venstre) skræller let af fra en elastomer. En kemisk bundet hydrogel og elastomer (til højre) er svære at skille fra hinanden, efterlader rester efter kredit:Suo Lab/Harv -
 Succesfuld syntese af nanomateriale, der forbedrer katalysatorens effektivitet(Venstre mod højre) Dr. Md Shahriar Hossain, Prof Yusuke Yamauchi og Dr. Katy Wood ved Quokka-instrumentet. Kredit:Australian Nuclear Science and Technology Organisation (ANSTO) Et stort internati
Succesfuld syntese af nanomateriale, der forbedrer katalysatorens effektivitet(Venstre mod højre) Dr. Md Shahriar Hossain, Prof Yusuke Yamauchi og Dr. Katy Wood ved Quokka-instrumentet. Kredit:Australian Nuclear Science and Technology Organisation (ANSTO) Et stort internati -
 Neutroner fanger formskiftende coronavirus-proteinkompleks på aktenKredit:Oak Ridge National Laboratory Mens alle vira har nogle midler til at bekæmpe kroppens immunsystem, forskere har undersøgt, hvordan SARS-CoV-2-coronavirus - årsagen til den globale COVID-19-
Neutroner fanger formskiftende coronavirus-proteinkompleks på aktenKredit:Oak Ridge National Laboratory Mens alle vira har nogle midler til at bekæmpe kroppens immunsystem, forskere har undersøgt, hvordan SARS-CoV-2-coronavirus - årsagen til den globale COVID-19-
- For renere luft, vand, og jord
- Ny indsigt i sociale normer kan drive positive sociale forandringer
- Arkæologer identificerer gamle nordamerikanske høje ved hjælp af ny billedanalyseteknik
- Modellering af tidligere og fremtidige gletsjeroversvømmelser i det nordlige Grønland
- Lys-vridende chiral nanoteknologi kunne fremskynde lægemiddelscreening
- Sådan beregnes Duct Airflow


