Design af biologisk bevægelse på nanometerskalaen
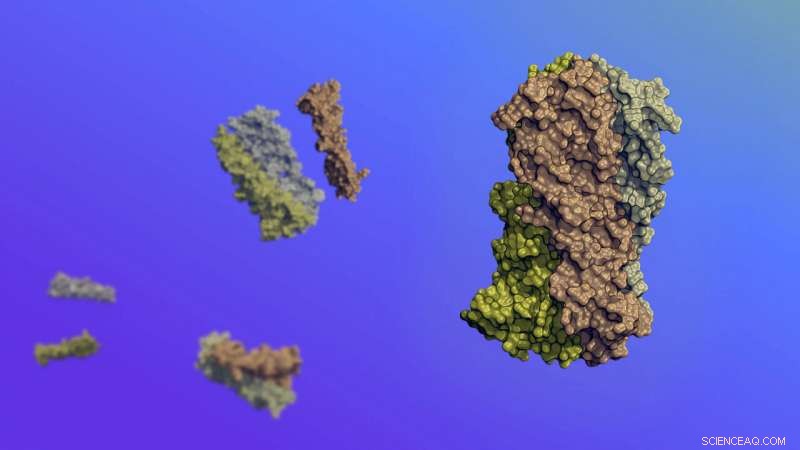
Molekylær kunst, der skildrer de nye proteiner, der kan bevæge sig forudsigeligt, afstembare måder som reaktion på deres miljø. Proteinerne blev designet fra bunden på computere, derefter produceret i levende celler. Kredit:Ian Haydon/Institute for Protein Design
Syntetiske proteiner er blevet skabt, som bevæger sig som reaktion på deres miljø på forudsigelige og afstembare måder. Disse bevægelige molekyler blev designet fra bunden på computere, derefter produceret inde i levende celler.
At fungere, naturlige proteiner skifter ofte deres former på præcise måder. For eksempel, blodproteinet hæmoglobin skal bøje sig, da det binder sig til og frigiver et iltmolekyle. At opnå lignende molekylær bevægelse ved design, imidlertid, har været en langvarig udfordring.
17. maj-udgaven af Videnskab rapporterer det vellykkede design af molekyler, der ændrer form som reaktion på pH-ændringer. (pH er en kemisk skala fra basisk til sur.)
Institute for Protein Design ved University of Washington School of Medicine ledede den multi-institutionelle forskning.
Forskerne satte sig for at skabe syntetiske proteiner, der selv samles i designede konfigurationer ved neutral pH og hurtigt skilles ad i nærvær af syre.
Resultaterne viste, at disse dynamiske proteiner bevæger sig efter hensigten og kan bruge deres pH-afhængige bevægelse til at forstyrre lipidmembraner, inklusive dem på endosomet, et vigtigt rum inde i celler.
Denne membranforstyrrende evne kunne være nyttig til at forbedre lægemiddelvirkningen. Voluminøse lægemiddelmolekyler, der leveres til celler, sætter sig ofte fast i endosomer. Sidder fast der, de kan ikke udføre deres tilsigtede terapeutiske effekt.
Endosomernes surhedsgrad adskiller sig fra resten af cellen. Denne pH-forskel fungerer som et signal, der udløser bevægelsen af designmolekylerne, derved sætter dem i stand til at forstyrre endosommembranen.
"Evnen til at designe syntetiske proteiner, der bevæger sig på forudsigelige måder, vil muliggøre en ny bølge af molekylær medicin, " sagde seniorforfatter David Baker, professor i biokemi ved UW School of Medicine og direktør for Institute for Protein Design. "Fordi disse molekyler kan permeabilisere endosomer, de har store løfter som nye værktøjer til medicinlevering."

Scott Boyken, en nylig postdoktor ved Institute for Protein Design ved University of Washington School of Medicine, designer nye proteinmolekyler med bevægelige dele. Kredit:Conrado Tapado/Institut for Protein Design
Forskere har længe søgt at konstruere endosomal flugt.
"At forstyrre membraner kan være giftigt, så det er vigtigt, at disse proteiner kun aktiveres under de rigtige forhold og på det rigtige tidspunkt, når de først er inde i endosomet, " sagde Scott Boyken, en nylig postdoc-stipendiat i Baker-laboratoriet og hovedforfatter på det nylige projekt.
Boyken opnåede molekylær bevægelse i sine designerproteiner ved at inkorporere et kemikalie kaldet histidin. Under neutrale (hverken basiske eller sure) forhold, histidin bærer ingen elektrisk ladning. I nærværelse af en lille mængde syre, den optager positiv ladning. Dette forhindrer den i at deltage i visse kemiske interaktioner. Denne kemiske egenskab ved histidin gjorde det muligt for teamet at skabe proteinsamlinger, der falder fra hinanden i nærvær af syre.
"At designe nye proteiner med bevægelige dele har været et langsigtet mål for mit postdoktorale arbejde. Fordi vi designede disse proteiner fra bunden, vi var i stand til at kontrollere det nøjagtige antal og placering af histidinerne, " sagde Boyken. "Dette lader os tune proteinerne til at falde fra hinanden ved forskellige niveauer af surhedsgrad."
Andre videnskabsmænd fra UW, Ohio State University, Lawrence Berkeley National Laboratory, og Howard Hughes Medical Institutes Janelia Research Campus bidrog til denne forskning.
Dem i Vicki Wysockis gruppe på OSU brugte naturlig massespektrometri til at bestemme mængden af syre, der er nødvendig for at forårsage adskillelse af proteinerne. De bekræftede designhypotesen om, at have flere histidiner ved grænseflader mellem proteinerne ville få samlingerne til at kollapse mere pludseligt.
Samarbejdspartnere i Kelly Lee-laboratoriet på UW School of Pharmacy viste, at designerproteinerne forstyrrer kunstige membraner på en pH-afhængig måde, der afspejler opførselen af naturlige membranfusionsproteiner.
Opfølgningsforsøg udført i Jennifer Lippincott-Schwartz' laboratorium på HHMI's Janelia Research Campus viste, at proteinerne også forstyrrer endosomale membraner i pattedyrsceller.
Omkonstruerede vira, der kan undslippe endosomer, er de mest almindeligt anvendte lægemiddelleveringsmidler, men vira har begrænsninger og ulemper. Forskerne mener, at et lægemiddelleveringssystem, der kun er lavet af designerproteiner, kan konkurrere med effektiviteten af viral levering uden de iboende ulemper.
Sidste artikelForskere udvikler teknologi til at fange tumorceller
Næste artikelKonstrueret mikrobiel produktion af druesmag
 Varme artikler
Varme artikler
-
 Forskere registrerer greenlight gasdetektering ved stuetemperaturSkyder. Kredit:MIPT Russiske forskere har udviklet en mekanisme til at detektere molekylært brint ved hjælp af grønt lys til at belyse en nanokrystallinsk sammensat sensor baseret på zink og indiu
Forskere registrerer greenlight gasdetektering ved stuetemperaturSkyder. Kredit:MIPT Russiske forskere har udviklet en mekanisme til at detektere molekylært brint ved hjælp af grønt lys til at belyse en nanokrystallinsk sammensat sensor baseret på zink og indiu -
 Mikroskopiteknik afslører detaljer i nanoskala af belægninger, når de tørrerLehigh University-forskere så en storm i en tekande, da de observerede mikrostrukturudviklingen af kolloid-polymerfilm under tørringsprocessen. Kredit:Kaewpetch, T., Gilchrist, J.F./Lehigh Universit
Mikroskopiteknik afslører detaljer i nanoskala af belægninger, når de tørrerLehigh University-forskere så en storm i en tekande, da de observerede mikrostrukturudviklingen af kolloid-polymerfilm under tørringsprocessen. Kredit:Kaewpetch, T., Gilchrist, J.F./Lehigh Universit -
 Neutroner undersøger molekylær adfærd hos foreslåede COVID-19 lægemiddelkandidaterBrug af neutroner, ORNL-forskere analyserede den molekylære dynamik i tidligere foreslåede COVID-19 lægemiddelkandidater remdesivir (til venstre), hydroxychlorokin (i midten), og dexamethason (til høj
Neutroner undersøger molekylær adfærd hos foreslåede COVID-19 lægemiddelkandidaterBrug af neutroner, ORNL-forskere analyserede den molekylære dynamik i tidligere foreslåede COVID-19 lægemiddelkandidater remdesivir (til venstre), hydroxychlorokin (i midten), og dexamethason (til høj -
 Kvantekemi løser mysteriet med de 20 aminosyrer i den genetiske kodeDe første 13 aminosyrer er karakteriseret ved meget ens kemisk hårdhed og elektroniske energiniveauer (vist på billedet som en enkelt cirkel). De nye aminosyrer blev mere og mere blødere og mere indiv
Kvantekemi løser mysteriet med de 20 aminosyrer i den genetiske kodeDe første 13 aminosyrer er karakteriseret ved meget ens kemisk hårdhed og elektroniske energiniveauer (vist på billedet som en enkelt cirkel). De nye aminosyrer blev mere og mere blødere og mere indiv
- Modellerer, hvordan tynde film går i stykker
- Hvilke stoffer gør ismelt langsommere?
- Molekylært hydrogen bliver semimetallisk ved tryk over 350 GPa
- Forbedring af kystrestaurering ved midlertidigt at efterligne naturen
- Truede planter i Amazonas regnskov
- Geovidenskabsfolk opdager en overset kilde til Jordens vand


