Forskere beriger sølvkemi
Illustration. Sølv. Kredit:@tsarcyanide/MIPT
Forskere fra Moskva Institut for Fysik og Teknologi har samarbejdet med kolleger i Rusland og Saudi -Arabien og foreslået en effektiv metode til at indhente grundlæggende data, der er nødvendige for at forstå kemiske og fysiske processer, der involverer stoffer i gasformig tilstand. Den foreslåede numeriske protokol forudsiger den termiske effekt af gasfasedannelse af sølvforbindelser og deres absolutte entropi. Dette inkluderer første gang sådanne data for over 90 forbindelser. Udgivet i tidsskriftet Uorganisk kemi , fundene er vigtige for praktisk anvendelse af stoffer, der indeholder sølv, herunder i vand- og sårdesinfektion, fotografering og skysåning.
Holdet udledte de præcise værdier for dannelsens entalpi og entropien af talrige sølvforbindelser. Entalpien (fra græsk "thalpein, "betyder" at opvarme ") i et system beskriver dets tilstand i form af energien i de bestanddelte partikler, tryk og volumen. Ifølge Hess lov, multiplicering af støkiometriske koefficienter og forskellen mellem dannelsesenthalpierne af reaktanterne og produkterne giver den mængde varme, der genereres eller forbruges i en kemisk reaktion. Entropi er et mål for, hvor uordnet et system er. Termodynamikkens anden lov siger, at et system spontant kan vedtage en mindre organiseret tilstand, så entropi stiger med tiden.
At kende værdierne for entalpi og entropi er afgørende for at forudsige, om en reaktion nogensinde vil forekomme under givne betingelser. Disse egenskaber angiver også, hvordan reaktionsudbytte og selektivitet - forholdet mellem produkter - varierer med temperatur og tryk, muliggør optimering. Resultaterne gør det muligt for forskere at forudsige kemiske processer, der forekommer i gasfasen. Dataene vil også hjælpe med at styre processerne involveret i tyndfilm og ren prøveudfældning fra gasfasen.
Der er dybest set to måder til bestemmelse af entalpi- og entropiændringer - enten gennem komplekse og dyre eksperimenter, eller ved at bruge dataene fra opslagsbøger og lave en regning baseret på Hess lov.
"Valget ser ud til at være indlysende, mere i betragtning af at du ikke eksperimentelt kan måle varmen i nogle reaktioner, "sagde Yury Minenkov, seniorforsker ved Laboratory of Supercomputing Methods in Condensed Matter Physics. "For eksempel, ufuldstændig grafitforbrænding giver altid både kulilte og kuldioxid. Så selv ved at måle reaktionens termiske effekt, vi kunne ikke bestemme kulilte dannelse entalpi.
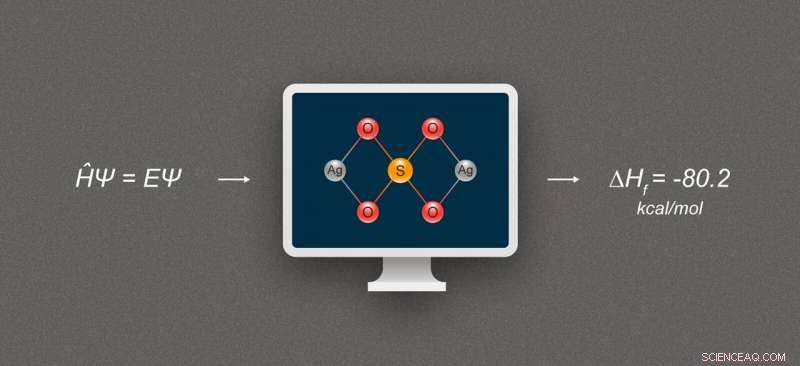
Figur 1. Forenklet diagram, der illustrerer beregning af dannelsesenthalpi for sølvforbindelser. Den afbildede forbindelse er sølvsulfat, Ag₂SO₄. Kredit:@tsarcyanide/MIPT
"Men den beregningsmæssige tilgang står over for nogle problemer, "Minenkov fortsatte." Først, entalpierne til dannelse og entropier er ikke kendt for hver forbindelse. Sekund, selvom data er tilgængelige, ingen kan garantere deres nøjagtighed. Værdierne varierer meget mellem opslagsbøger. Til tider, målefejlene kan være ret store. "
Heldigvis kvantekemi hjælper med at opnå entropien og til en vis grad, entalpidata. Hvert bestanddel af et gasformigt molekyle kan ses som et system af positivt ladede kerner og negativt ladede elektroner. Forskere kan derefter anvende elektroniske strukturberegningsmetoder til at løse den molekylære Schrödinger -ligning. Dette afslører molekylets samlede elektroniske energi, dens bølgefunktion, og den rumlige konfiguration af kerner - det vil sige dens 3-D geometriske struktur. Fysikere kan derefter beregne entropien og entalpien for en ideel gas sammensat af sådanne molekyler. De entropi -værdier, der opnås på denne måde, indføres derefter i opslagsbøger og bruges i termodynamiske beregninger.
Problemet med entalpi er, at ikke er en grundlæggende værdi på dette tidspunkt, det afhænger væsentligt af den valgte metode til beregning af Schrödinger -ligninger.
Atomiseringsreaktioner bruges sædvanligvis til at beregne dannelsesenthalpien. I sådanne reaktioner, forbindelsen af interesse brydes ned i individuelle atomer. For eksempel, sølvsulfid — Ag 2 S - giver et svovl og to sølvatomer. Da entalpierne til dannelse af atomstoffer er velkendte og rapporteret i opslagsbøger, det er muligt at beregne dannelsesenthalpien for det oprindelige stof - i dette tilfælde sølvsulfid - ved at finde entalpiændringen i reaktionen via kvantekemiske metoder.
Imidlertid, når molekyler sammensat af mange atomer gennemgår atomisering, dette påvirker den elektroniske struktur i en sådan grad, at entalpi, også, er markant ændret. De aktuelt tilgængelige metoder til teoretisk kemi kan ikke redegøre for disse effekter med tilstrækkelig nøjagtighed.
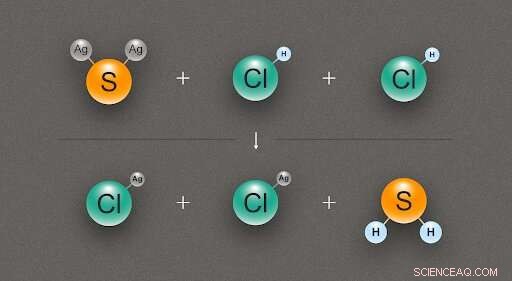
Figur 2. Et diagram, der illustrerer den kemiske reaktion mellem et sølvsulfid (Ag₂S) og to saltsyre (HCl) molekyler, producerer to molekyler sølvchlorid (AgCl) og et af hydrogensulfid (H₂S). Kredit:@tsarcyanide/MIPT
Forskerteamet fra MIPT, Frumkin Institute of Physical Chemistry and Electrochemistry fra det russiske videnskabsakademi, Ivanovo State University of Chemistry and Technology, og Saudi -Arabiens kong Abdullah University of Science and Technology har udgivet en række artikler, der foreslår en måde at beregne de termodynamiske egenskaber ved organiske og uorganiske forbindelser med mere nøjagtighed.
I tilfælde af sølvsulfid, forskerne fandt sin entalpi for dannelse fra reaktionen med saltsyre, hvilket giver sølvchlorid og hydrogensulfid (fig. 2). Da antallet af obligationer i den øverste række er det samme som i den nederste række, ændringen i energi kan beregnes med den mindste fejl.
Dannelsesvarmen for sølvchlorid, svovlbrinte, og saltsyre er kendt med høj nøjagtighed, og computermodellering afslører reaktionens termiske effekt. Ud fra disse data, det er muligt at udlede varmen for dannelse af sølvsulfid ved hjælp af Hess 'lov.
"Den klassiske koblede klynge tilgang, kendt som CCSD (T), er guldstandarden for løsning af den elektroniske Schrödinger -ligning i moderne kvantekemi, "Minenkov forklarede." Vi erstattede den med den lokale version kaldet DLPNO-CCSD (T), som blev udviklet for ikke længe siden på Max Planck Institute. Dette skrumpede den nødvendige computerkraft med en størrelsesorden. Under den konventionelle CCSD (T), beregningstiden varierer med molekylets størrelse N som N 7 , så det er ikke en mulighed for store molekyler. Den lokale version er meget mindre tid- og ressourcekrævende. "
Teamet begyndte med at kontrollere, hvor godt resultaterne af deres kvantekemiske beregninger stemte overens med de eksperimentelle termodynamiske og strukturelle data. Opslagsbøger rapporterede værdierne for 10 sølvforbindelser, og de var et godt match. Efter at have sikret, at deres model er tilstrækkelig, forskerne beregnede de termodynamiske egenskaber for 90 sølvforbindelser, der mangler i bøgerne. Dataene kan bruges til både forskere, der arbejder inden for sølvkemi og til test og kalibrering af nye metoder til elektronisk strukturberegning.
Sidste artikelNRL pigmentpakke til skibe bremser misfarvning, sænker soltemperaturbelastningen
Næste artikelSniff-cam for at opdage sygdom
 Varme artikler
Varme artikler
-
 Sådan beregnes den empiriske formelDen empiriske formel i kemi giver det relative antal af hver type atom i et bestemt molekyle. Det giver ikke det nøjagtige antal af hver type atom i molekylet, og det giver heller ingen oplysninger om
Sådan beregnes den empiriske formelDen empiriske formel i kemi giver det relative antal af hver type atom i et bestemt molekyle. Det giver ikke det nøjagtige antal af hver type atom i molekylet, og det giver heller ingen oplysninger om -
 Fra kontorvinduer til Mars:Forskere debuterer med superisolerende gelQingkun Liu, en postdoktoral forskningsassistent ved CU Boulder, holder prøver af en ny gel, der kan forbedre energieffektiviteten af vinduer i hele USA. Kredit:CU Boulder En ny, superisolerende
Fra kontorvinduer til Mars:Forskere debuterer med superisolerende gelQingkun Liu, en postdoktoral forskningsassistent ved CU Boulder, holder prøver af en ny gel, der kan forbedre energieffektiviteten af vinduer i hele USA. Kredit:CU Boulder En ny, superisolerende -
 5 måder at vide, om der er sket en kemisk ændringI nogle kemiske reaktioner kombineres atomer til dannelse af nye molekyler eller forbindelser, mens andre kemiske reaktioner får atomerne til at gå fra hinanden eller handle steder med et andet atom.
5 måder at vide, om der er sket en kemisk ændringI nogle kemiske reaktioner kombineres atomer til dannelse af nye molekyler eller forbindelser, mens andre kemiske reaktioner får atomerne til at gå fra hinanden eller handle steder med et andet atom. -
 Ny metode beregner ligevægtskonstanten i lille skalaBlanding af beregningskemi og teoretisk matematik viste sig at være en vindende formel for Emory-kemikeren James Kindt (i midten), hans kandidatstuderende (fra venstre) Xiaokun Zhang og Lara Patel, og
Ny metode beregner ligevægtskonstanten i lille skalaBlanding af beregningskemi og teoretisk matematik viste sig at være en vindende formel for Emory-kemikeren James Kindt (i midten), hans kandidatstuderende (fra venstre) Xiaokun Zhang og Lara Patel, og
- Når MSNBC eller Fox News sendes på offentlige steder, hvordan reagerer folk?
- Forskere demonstrerer hastighed, præcision af in situ planetarisk dating enhed
- Brug af en selektiv lysabsorber til at bygge et fototermisk katalysesystem
- Tilbagegående Malawi -sø bærer omkostninger ved klimaændringer
- Projekterne er gode nu finder undersøgelse om HUD Rental Assistance Demonstration Program
- Kan vi nogensinde udskifte plastik?


