Historien om indsigtsfuld HIV-forskning inspirerer neutronspredningstilgang til at studere COVID-19
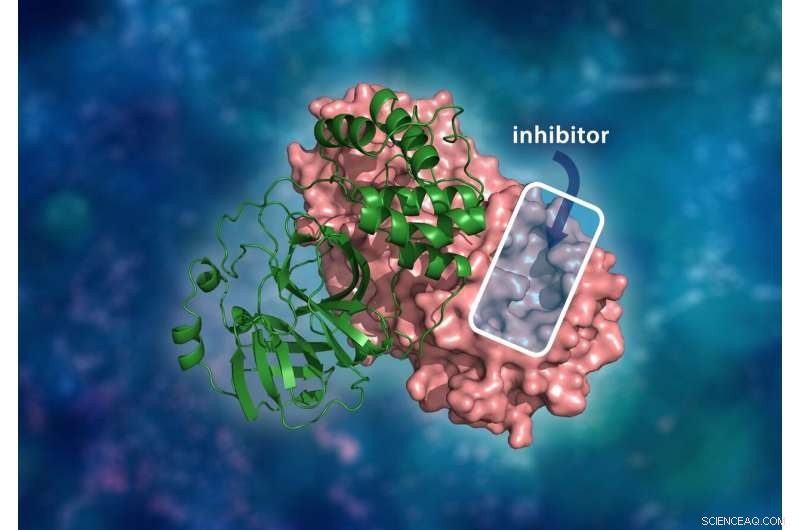
Den tredimensionelle struktur af SARS-CoV-2 hovedproteasen. Det molekylære dimerkompleks består af en enkelt monomer (grøn) bundet til en anden monomer (lyserød), hvor en lægemiddelinhibitor vil binde til et katalytisk steds hulrum for at forhindre virussen i at replikere. Kredit:ORNL/Andrey Kovalevsky, Jill Hemman
Mens den nye coronavirus fortsætter med at sprede sig, forskere leder efter nye måder at stoppe det på. Men for to videnskabsmænd, at se på fremtiden betyder at hente inspiration fra fortiden.
I januar 2020, Andrey Kovalevsky og Daniel Kneller, forskere ved Department of Energy's (DOE's) Oak Ridge National Laboratory (ORNL), forberedte sig på at bruge neutroner til at studere forholdet mellem en bestemt HIV-protease - et proteinenzym, der tillader virussen at replikere sig selv i den menneskelige krop - og en klasse af antiretrovirale lægemidler kendt som HIV-proteasehæmmere. Nogle typer HIV opbygger resistens over for disse lægemidler. Forskernes mål var at få en bedre forståelse af, hvordan proteasevariationer virker, for at hjælpe udviklingen af banebrydende behandlinger til at overvinde selv de hårdeste resistente stammer af HIV.
Da holdet begyndte deres arbejde, lidt vidste de det, tilfældigvis, deres indsats for at studere HIV ville hurtigt sætte dem på en ny vej til at tackle COVID-19, pandemien, der nu har verden i sit greb.
Det viser sig, den enzymatiske aktivitet af protease, der sætter HIV i stand til at reproducere - selve den mekanisme, som Kovalevskys team forberedte sig på at undersøge med neutroner - er den samme replikationsmekanisme som anvendes af SARS-CoV-2, virus, der forårsager sygdommen COVID-19.
Nu, holdet har flyttet fokus på den eksperimentelle tilgang, de havde til hensigt at bruge til at studere HIV for at bekæmpe den nye globale trussel.
HIV-studier drejer sig om ny coronavirus
Kovalevsky har studeret hiv i 15 år. Som neutronkrystallograf, han studerer små krystalliserede prøver af biologisk stof ved at bombardere dem med neutroner. Neutronspredningsteknikken er yderst effektiv til at afsløre, hvordan en prøves atomstruktur er arrangeret, og hvordan dens atomer opfører sig. Afhængig af målet, indsamlede indsigter kan give vejledning i, hvordan man enten forbedrer eller endda undertrykker visse egenskaber ved et biologisk materiale.
Neutroner er et ideelt værktøj til at studere biologiske strukturer og adfærd på grund af deres akutte følsomhed over for lette elementer som brint og deres evne til at sondere sådanne materialer uden at beskadige dem.
I 2019, Kovalevsky satte sig for at studere HIV på en måde, som aldrig var blevet gjort før. Ved at bruge uelastisk neutronspredning ville han kunne indsamle data om dynamikken, eller bevægelserne, af en HIV-protease, hvilket ville føje til de neutrondiffraktionsdata, han havde indsamlet i årevis. At have både den strukturelle og adfærdsmæssige – eller dynamiske – information ville give et mere fuldstændigt billede af, hvordan virussen virker og, på tur, kan føre til nye fremskridt inden for behandlinger.
Efter at have brugt VISION-spektrometeret ved ORNL's Spallation Neutron Source (SNS) - et neutronspredningsinstrument, der afslører atomernes bevægelser baseret på deres vibrationer - indså Kovalevsky, at han havde brug for hjælp til at analysere dataene.
"Daniel bringer ekspertise inden for viral proteaseforskning, " forklarede Kovalevsky om at rekruttere Kneller. "Han ved, hvordan man arbejder med proteinerne i laboratoriet. Han kender alle laboratorieteknikker med hensyn til proteinproduktion, rensning, krystallisation, indsamling af krystallografisk data, og analyse for at opnå indsigt i lægemiddeldesign."
Det tog omkring 8 måneder at ansætte Daniel efter en omfattende søgning, siger Kovalevsky. Kneller – som har specialiseret sig i at studere HIV-protease ved hjælp af krystallografi – sluttede sig til Kovalevskys team i januar 2020 for at hjælpe med det eksperimentelle og beregningsmæssige arbejde med HIV-proteasen.
Men lige da holdet var klar til at dykke ind, COVID-19 var blevet global, og forskningen ramte et hårdt stop.

Postdoc-forsker Daniel Kneller bruger ORNL's Center for Strukturel og Molekylær Biologi til at syntetisere krystalliserede proteiner relateret til COVID-19 og forberede dem til neutronspredningsstudier ved Spallation Neutron Source og High Flux Isotope Reactor. Kredit:ORNL/Carlos Jones
Skifte gear, få tidlige resultater
I marts, personale i ORNL's Neutron Sciences udviklede en plan for at studere nøglekomponenter af COVID-19 ved at samle forskerhold og omprioritere driftsplanerne for væsentlige instrumenter på de to neutronspredningsfaciliteter på ORNL, SNS og High Flux Isotope Reactor (HFIR).
Efter allerede at have lagt grunden til at studere protease, Kovalevsky og Kneller skiftede omgående fra HIV til den nye coronavirus. Specifikt, de er i øjeblikket fokuseret på hovedproteasen af SARS-CoV-2, virus, der forårsager COVID-19 sygdommen.
"SARS-CoV-2-proteasen er et enzym, der skærer proteiner, der gør virussen i stand til at formere sig. At forstå, hvordan proteasen er samlet, og hvordan den fungerer, er et kritisk første skridt til at finde effektive lægemiddelhæmmere til at blokere virussens replikationsmekanisme, " sagde Kovalevsky. "I lighed med HIV-proteasen, Hovedproteasen fra SARS-CoV-2-virussen er et af de mest attraktive lægemiddelmål lige nu til at designe specifikke inhibitorer."
Som med den oprindelige plan for HIV-arbejdet, holdet forbereder sig på at bruge instrumenter på SNS og HFIR for at få grundlæggende indsigt i, hvordan atomerne i proteasen er arrangeret. Ved at bruge instrumenterne ManDi og IMAGINE, forskerne vil være i stand til at sammensætte proteasens atomstruktur ved at bruge neutroner til at spore brintatomerne i de krystalliserede proteinprøver.
Men først, de skal skaffe krystaller af høj kvalitet, der er store nok til neutronforsøg. Det er her, holdet har gjort betydelige fremskridt tidligt.
Krystalkvalitet bestemmes først af, hvor godt de diffrakterer, eller sprede, Røntgenstråler. Typisk, denne proces udføres på et synkrotronanlæg, hvor krystallerne kan være frosset til omkring 100 K (eller omkring -280°F).
Holdet brugte proteinkrystalliserings- og karakteriseringslaboratoriet på SNS til at dyrke SARS-CoV-2-proteasekrystaller, hvilket tog omkring en uge til 10 dage. For at analysere kvaliteten af krystallerne, de brugte den lokale røntgenmaskine, et Rigaku HighFlux HomeLab, hvilket gav flere nøgleresultater.
Først, røntgenforsøgene bekræftede, at krystallerne var af høj kvalitet, og at den metode, der blev brugt til at dyrke dem, kunne producere større krystaller, der var egnede til neutronforsøg. Sekund, at have en lokal maskine tillod dem at indsamle røntgenmålinger ved stuetemperatur, omkring 70°F.
Rumtemperaturmålingerne gjorde det muligt for dem at observere plasticiteten, eller fleksibilitet, af proteasestrukturen, give mærkbar information om, hvordan strukturen opfører sig under forhold tæt på virussens fysiologiske miljø. Disse data kunne ikke være opnået ved hjælp af frosne prøver.
"Dette er en vigtig milepæl i vores bestræbelser på at lave neutrondiffraktion. Investeringen i en lokal røntgenmaskine har givet ret godt resultat, sagde Kneller. I et tilfælde, vi dyrkede krystaller om mandagen og indsamlede data om dem om tirsdagen. Ellers, for at få den information skal du sende dine krystaller til en synkrotron, hvilket kan tage dage til uger."
"Og lige nu, på grund af pandemien, du kan ikke gå til en synkrotron, " tilføjede Kovalevsky. "Og for at analysere krystaller ved stuetemperatur, du skal være der."
"De oplysninger, vi lærte fra stuetemperaturstrukturen, har evnen til øjeblikkeligt at påvirke de beregningsmæssige retninger, forskere bruger. Vi fandt nogle forskelle mellem vores stuetemperatur nær-fysiologiske struktur og de frosne strukturer fra synkrotronerne, som kan have betydning for beregningsarbejdet, såsom de små molekyle docking undersøgelser, der udføres på ORNL's supercomputer Summit, " sagde Kneller.

Mikroskopisk visning af SARS-CoV-2 proteasekrystallerne dyrket i ORNLs proteinkrystalliserings- og karakteriseringslaboratorium. Når krystaller når en vis størrelse og form, de vil blive brugt i neutronspredningsforsøg for at bestemme, hvordan SARS-CoV-2-hovedproteasen er opbygget, og hvordan den opfører sig. Kredit:ORNL/Daniel Kneller
"Indtil nu, vi har haft stor succes med vores tidlige undersøgelser af COVID-19. Vi har allerede indsendt et manuskript til offentliggørelse om vores strukturelle fund, hvor vi i det væsentlige har udført to måneders forskning, som normalt kunne have taget et år."
Leighton Coates hjalp Kovalevsky og Kneller i data- og strukturanalysen af proteinkrystallerne, en instrumentforsker på SNS MaNDi-diffraktometeret, som også er medlem af det krystallografiske team, der studerer SARS-CoV-2-proteasen.
Data genereret i løbet af de næste mange måneder vil blive delt med andre nationale laboratorier, universiteter, og det bredere videnskabssamfund til at bygge mere nøjagtige modeller for beregningssimuleringer, der bruges til at identificere potentielle lægemiddelkandidater til at stoppe virussen.
"Det videnskabelige samfund har reageret hurtigt på COVID-19-pandemien. Vi er heldige at kunne yde vores egne bidrag ved at udnytte mange års erfaring med at studere HIV til at opbygge en bedre forståelse af, hvordan den nye coronavirus replikerer, og hvordan vi kan bekæmpe den ved at hæmmer dets essentielle protease, " sagde Kovalevsky.
Forsker i HIV-resistens
Før pandemien vendte deres opmærksomhed og indsats mod at forske i SARS-CoV-2, Kovalevsky og Kneller havde en klar plan for at angribe hiv.
39 millioner mennesker verden over er smittet med HIV. At give disse mennesker bedre behandlingsmuligheder ville ikke kun forbedre deres livskvalitet, men også forhindre denne sygdom i at sprede sig yderligere.
HIV-proteasen virker ved at spalte uskadelig, eller ikke-funktionel, proteinstrenge til mindre proteiner, omdanner dem til funktionelle virale proteiner, der gør det muligt for virussen at samle sig og fortsætte med at inficere raske menneskelige celler. Generelt, HIV-proteasehæmmere er ret effektive til at blokere protease under HIV-replikation, men nogle variationer af protease har udviklet en evne til at modstå lægemiddelinhibitorer.
"Hvis vi kan lære mere om de molekylære mekanismer, der gør HIV-proteasevarianter lægemiddelresistente, vi kan designe lægemidler, der er bedre rustet til at overliste dets forsvar, " sagde Kneller.
Specifikt, Kneller og Kovalevsky ønskede at udforske PRS-17, en unik HIV-proteasevariant, der er 10, 000 gange mindre tilbøjelige end andre ikke-resistente varianter til at blive hæmmet af de mest effektive kliniske HIV-proteasehæmmere, der er tilgængelige i øjeblikket. Kovalevsky forklarede, at selvom hiv-behandlingsprogrammer er nået langt siden hiv-pandemien begyndte i 1980'erne, mutante varianter som PRS-17, som følge af langvarig behandling, kunne kompromittere mange års farmaceutisk innovation og fremskridt og resultere i mislykkede antivirale behandlinger.
"Stofresistens er nu det største problem for HIV-patienter. Med den rette behandling, patienter kan leve lange og lykkelige liv med uopdagelige niveauer af hiv i deres system. De vil ikke udvikle AIDS eller sprede HIV til andre. Men PRS-17 og andre lægemiddelresistente HIV-proteasevarianter gør det vanskeligt for læger at bekæmpe HIV hos deres patienter, " sagde Kovalevsky.
Det er svært at forstå præcis, hvordan PRS-17 neutraliserer virkningen af HIV-proteasehæmmere, siger forskerne. Viruss proteiner er komplekse systemer, og PRS-17 har evnen til at anvende flere forskellige mekanismer til at beskytte sig mod antiretrovirale lægemidler.
"Det er en udfordring at finde ud af, hvordan PRS-17 modstår HIV-proteasehæmmere, men en som vi absolut skal overvinde. PRS-17 er et klinisk isolat, hvilket betyder, at det kom fra en faktisk patient, der kæmper for at bekæmpe denne sygdom, " forklarede Kneller. "At lære mere om det kan redde mange patienters liv, fordi den viden, vi får ved at bruge neutroner på PRS-17, vil kunne overføres til andre lignende ekstremt lægemiddelresistente proteasevarianter."
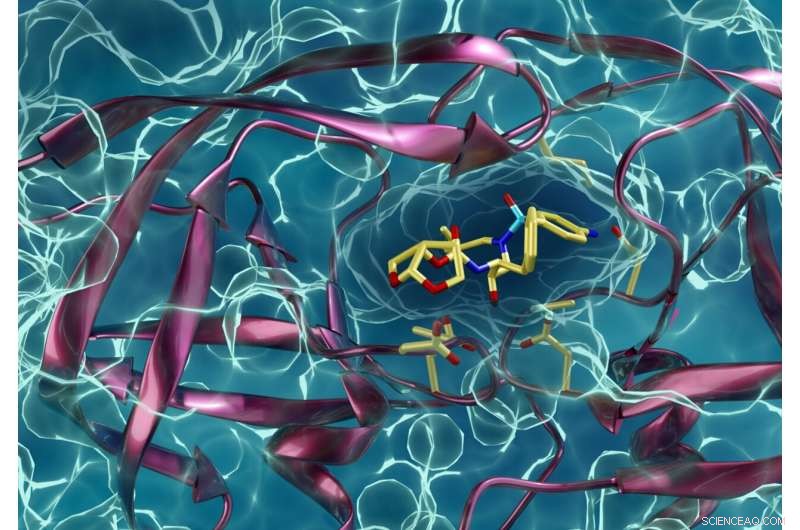
En lægemiddelresistent type HIV-protease, der interagerer med en HIV-proteasehæmmer. Kneller og Kovalevsky håber, at de samme teknikker, som de har brugt til at lære mere om hiv, også vil hjælpe andre forskere med at bekæmpe COVID-19. Kredit:ORNL/Jill Hemman
Holdet havde til hensigt at skabe et kort over PRS-17-proteasen for bedre at forstå de molekylære mekanismer bag dens lægemiddelresistens. Det indebar at bruge instrumenterne ManDi og VISION hos SNS og IMAGINE-instrumentet hos HFIR.
"Det var meget den samme tilgang, som vi nu forsøger med COVID-19, " sagde Kovalevsky.
Med ManDi og IMAGINE, Kneller og Kovalevsky planlagde at sondere krystalliserede prøver af PRS-17-protease for at generere detaljerede data om dens statiske atomstruktur. Brug af VISION ville sætte dem i stand til at sondere pulveriserede prøver af PRS-17-protease for at give indsigt i dets dynamiske egenskaber ved at måle de molekylære vibrationer.
Neutroner er særligt velegnede til at studere komponenter af vira som HIV (eller SARS-CoV-2) på grund af deres følsomhed over for brint, en vigtig bestanddel af alle proteiner. Med neutronkrystallografi, holdet kunne præcist lokalisere hvert brintatom i PRS-17's protease, giver dem hidtil uset indsigt i, hvordan proteinet fungerer, og hvilke interaktioner det gennemgår med en proteasehæmmer.
"Brug neutronkrystallografi ved MaNDi og IMAGINE til at lokalisere hydrogenatomer i krystaller af PRS-17-protease, ville sætte os i stand til at opbygge en omfattende profil af dens statiske struktur, " sagde Kneller. "Med VISION, vi ville også spore brintatomer, men vi ville bruge pulveriserede prøver af PRS-17-protease, der er blevet rehydreret for at efterligne de overfyldte forhold for en HIV-viruspartikel. Det ville give os mulighed for at se dens dynamiske egenskaber og lære mere om, hvordan den kan bevæge sig, når den arbejder i en viral partikel."
Kneller forklarede, at det er vigtigt at få information om både de statiske og dynamiske egenskaber af PRS-17 for at udvikle en fuldstændig forståelse af denne viruss resistens over for antiretrovirale lægemidler.
"Hvis jeg sporede din placering kun én gang om dagen ved midnat, Jeg vil tro, du bruger al din tid derhjemme. Men virkelig, du bevæger dig en del i løbet af dagen. Derfor er det vigtigt at indsamle både statiske og dynamiske målinger af vores prøve. Det lader os opbygge et mere fuldstændigt billede af proteases adfærd, " sagde Kneller.
"Uden neutronkrystallografi, forskere er nødt til at foretage kvalificerede gæt om, hvor brintatomer er i et protein, når de forsøger at forstå, hvordan proteinet gør sit arbejde, " tilføjede Kneller. "Disse typer eksperimenter, som Andrey har lavet tidligere, har faktisk været i stand til at bekræfte placeringen af disse hydrogenatomer i ikke-resistente HIV-proteasevarianter, men aldrig i en ekstremt lægemiddelresistent proteasevariant. Det betyder, at vi ville være i stand til at producere helt unikke og nye data om denne protease."
Kneller og Kovalevsky håber på en dag at generere data gennem deres eksperimenter, som vil blive en uvurderlig ressource for forskere, der ønsker at bekæmpe medicinresistente stammer af HIV.
"Det er en holdindsats. Kemikere, biologer, og fagfolk fra den farmaceutiske industri skal alle arbejde sammen for at bekæmpe sygdom, sagde Kneller. Sammen, vi kan udvikle effektive behandlinger til lægemiddelresistente stammer af HIV."
Forskning blev støttet af DOE Office of Science gennem National Virtual Biotechnology Laboratory, et konsortium af DOE nationale laboratorier fokuseret på reaktion på COVID-19, med finansiering fra Coronavirus CARES Act.
Sidste artikelRadioaktiv sky over Europa havde civil baggrund
Næste artikelEt minuts samtidig analyse af skarphedskomponenter i kimchi
 Varme artikler
Varme artikler
-
 Hvad er tilskuerioner?Tilskuereioner er ioner, der findes i en opløsning, men ikke deltager i en opløsnings kemiske reaktion. Når reaktanter dissocieres til ioner, kan nogle af ionerne kombineres og danne en ny forbindelse
Hvad er tilskuerioner?Tilskuereioner er ioner, der findes i en opløsning, men ikke deltager i en opløsnings kemiske reaktion. Når reaktanter dissocieres til ioner, kan nogle af ionerne kombineres og danne en ny forbindelse -
 Strontiumtitanats nye egenskaber er vigtige for elektronikforskningEPR-spektre for de (001)-orienterede enkeltkrystalprøver med form som en stang og en plade af STO:Fe3+ ved T =300 K (a) og af en plade af STO:Mn4+ ved T =150 K (b) . Orienteringerne af prøverne i forh
Strontiumtitanats nye egenskaber er vigtige for elektronikforskningEPR-spektre for de (001)-orienterede enkeltkrystalprøver med form som en stang og en plade af STO:Fe3+ ved T =300 K (a) og af en plade af STO:Mn4+ ved T =150 K (b) . Orienteringerne af prøverne i forh -
 Porøse materialer måler temperatur på molekylært niveauKredit:CC0 Public Domain Forskere fra Gent Universitet undersøgte, hvordan såkaldte metal-organiske rammer ånder, når det bliver varmere eller koldere. Ved hjælp af avancerede computersimuleringer
Porøse materialer måler temperatur på molekylært niveauKredit:CC0 Public Domain Forskere fra Gent Universitet undersøgte, hvordan såkaldte metal-organiske rammer ånder, når det bliver varmere eller koldere. Ved hjælp af avancerede computersimuleringer -
 Røntgenforsøg bidrager til undersøgelser af et lægemiddel, der nu er godkendt til at bekæmpe tu…En Pretomanid pille. Lægemidlet blev udviklet af nonprofit TB Alliance. Kredit:TB Alliance U.S. Food and Drug Administration har godkendt et nyt antibiotikum, i kombination med to eksisterende ant
Røntgenforsøg bidrager til undersøgelser af et lægemiddel, der nu er godkendt til at bekæmpe tu…En Pretomanid pille. Lægemidlet blev udviklet af nonprofit TB Alliance. Kredit:TB Alliance U.S. Food and Drug Administration har godkendt et nyt antibiotikum, i kombination med to eksisterende ant
- Årsagen blåhvaler er ikke endnu større? Deres Hearts
- Sådan beregnes procentvis tilbagegang
- Fra 3-D til 2-D og tilbage:reversibel omdannelse af lipidkugler til ultratynde ark
- Jordskælv i 4,6-størrelsesorden rasler Hawaiis Big Island
- Forbrugerelektronik har ændret sig meget på 20 år - systemer til håndtering af e-affald følger …
- Hvordan bliver en oversvømmelse til en katastrofe?


