Antibakterielt prodrug ved at målrette mod intracellulær metabolit
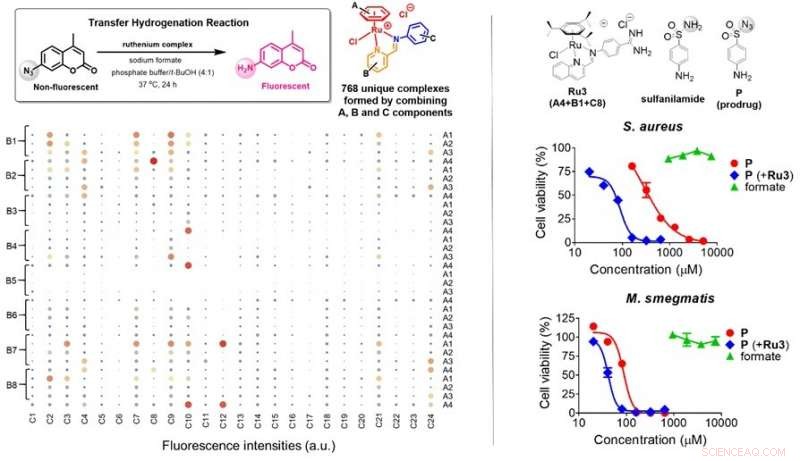
(Venstre) I alt 768 (4x8x24) unikke rutheniumkomplekser blev genereret via selvsamlingsreaktioner ved hjælp af molekylære komponenter A (4 typer), B (8 typer) og C (24 typer) i vandige opløsninger, derefter screenet for transferhydrogeneringsaktiviteter i nærvær af formiat. Størrelsen af skraverede cirkler angiver effektiviteten af rutheniumkomplekser til at udføre transferhydrogenering på proben, hvilket fører til fluorescens-tænding. Seks mulige kandidater blev identificeret. (Til højre) Antibakterielle egenskaber af prodrug P (rød) i S. aureus og M. smegmatis blev tændt i nærværelse af Ru3 (blå), mens tilskud af formiat (grøn) ikke havde nogen effekt på bakteriel vækst. Ru3, samlet i A4, B1 og C8, var i stand til at bruge formiat til stede i bakterieceller til at aktivere P. Kredit: Angewandte Chemie International Edition
National University of Singapore forskere har udviklet en tilgang til selektivt at målrette mod patogene bakterier ved at udnytte en intracellulær metabolit kendt som formiat, rigeligt med disse bakterier, som en ny antimikrobiel strategi. Formiat er en essentiel metabolit, der er nødvendig for vækst i visse patogene stammer, men findes kun i små mængder i pattedyrsceller.
Bakterielle mikroorganismers overflod og udvikling af patogen adfærd giver anledning til antibiotikatolerance og -resistens, som udgør en fare for den globale folkesundhed. Nye terapeutiske strategier er derfor nødvendige for at holde trit med denne voksende trussel.
Forskerholdet ledet af prof Ang Wee Han fra Institut for Kemi, NUS foreslog en ny tilgang til at målrette bakterier ved at udnytte formiat, en cellemetabolit, der kun findes i bestemte bakteriearter, at aktivere et antibakterielt prodrug og selektivt hæmme bakterievækst. Forskerne udviklede et molekylært bursystem til sulfonamid-antibakterielle lægemidler ved at erstatte deres essentielle amidfunktionsgruppe med azid (N 3 - ). De fandt også en vandstabil forbindelse (organorutheniumkompleks), der kan frigive disse antibakterielle lægemidler under visse betingelser efter screening gennem 768 unikke rutheniumkomplekser. Når de bruges sammen, de antibakterielle lægemidler frigives i nærvær af endogent formiat, der findes i bakterieceller. Denne strategi udnyttede formater, en nødvendig ingrediens for bakteriel vækst, som et våben til at aktivere sulfonamid-prodrugs ved hjælp af rutheniumkomplekser udviklet af forskerne.
Prof Ang sagde, "Dette er den første rapport, der udnytter unik cellulær metabolit til at udløse prodrug-aktivering i bakterier. Det baner vejen for en ny tilgang til målrettet antibakteriel terapi ved at udnytte forskelle i forekomsten af naturlige metabolitter blandt patogene stammer."
Det rationelt designede sulfonamid-prodrug med azid-caging-del blev effektivt aktiveret af organoruthenium-komplekserne i bakterier med rigelige mængder af formiat med op til 8-fold forbedring af lægemiddeleffektiviteten, især i de patogene bakterier, Staphylococcus aureus og Escherichia coli. I modsætning, øget effektivitet ved Mycobacterium smegmatis, som har begrænset formateringskapacitet, kun forøget dobbelt. Dette validerede tesen om, at intracellulært metabolitformiat kan målrettes for udviklingen af nye antibakterielle terapeutiske strategier.
Prof Ang sagde, "Antibiotikaresistens er en af de mest alvorlige udfordringer, som menneskeheden står over for, og alligevel har udviklingen af nye antibiotika ikke holdt trit med denne voksende trussel. Det unikke bakterielle metabolom giver nye muligheder for at løse dette problem. Vi håber, at denne opdagelse vil anspore til ny forskning, der retter sig mod forskellige metabolitter til udvikling af bedre og mere selektive antibakterielle midler. "
Forskerholdet arbejder på at udvikle andre prodrug-aktiveringsstrategier, der kan udnytte endogent bakterielt format. Ud over, undersøgelser af andre kliniske antibiotika, såsom trimethoprim og sulfamethoxazol, er også i gang.
 Varme artikler
Varme artikler
-
 Sous vide tilberedningsmetode gør oksekødsprotein mere fordøjeligtKredit:American Chemical Society Engang brugt til at tilberede køkken på kun de fineste restauranter, sous vide er nu på vej ind i hjemmekokernes køkkener. Fransk for under vakuum, Teknikken indeb
Sous vide tilberedningsmetode gør oksekødsprotein mere fordøjeligtKredit:American Chemical Society Engang brugt til at tilberede køkken på kun de fineste restauranter, sous vide er nu på vej ind i hjemmekokernes køkkener. Fransk for under vakuum, Teknikken indeb -
 At møde en 100 år gammel udfordring kan føre vejen til digitale aromaerLugte kan måles ved deres afstand fra hinanden. Kredit:Weizmann Institute of Science Dufte – der lover mystik og intriger – blandes af mesterparfumører, deres opskrifter holdt hemmelige. I en ny u
At møde en 100 år gammel udfordring kan føre vejen til digitale aromaerLugte kan måles ved deres afstand fra hinanden. Kredit:Weizmann Institute of Science Dufte – der lover mystik og intriger – blandes af mesterparfumører, deres opskrifter holdt hemmelige. I en ny u -
 Godt forbundet gennem amiderKredit:CC0 Public Domain Sammenkobling af molekylære komponenter gennem amidbindinger er en af de vigtigste reaktioner i forskning og den kemiske industri. I journalen Angewandte Chemie , fors
Godt forbundet gennem amiderKredit:CC0 Public Domain Sammenkobling af molekylære komponenter gennem amidbindinger er en af de vigtigste reaktioner i forskning og den kemiske industri. I journalen Angewandte Chemie , fors -
 Simuleret mikrogravitationssystem skabt til at eksperimentere med materialerKredit:CC0 Public Domain Krystalliseringsundersøgelser udført i rumlaboratorier, som er dyre og uoverkommelige for de fleste forskningslaboratorier, viste de værdifulde virkninger af mikrogravitat
Simuleret mikrogravitationssystem skabt til at eksperimentere med materialerKredit:CC0 Public Domain Krystalliseringsundersøgelser udført i rumlaboratorier, som er dyre og uoverkommelige for de fleste forskningslaboratorier, viste de værdifulde virkninger af mikrogravitat
- Gørt ved havet, Australien står over for en alvorlig klimaudfordring
- Sød opdagelse:Ny undersøgelse skubber chokolades oprindelse tilbage
- Ny teknik til hurtigt at dræbe bakterier ved hjælp af bittesmå guldskiver og lys
- Klemning af vesikler gennem snævre forsnævringer viser løfte om målrettet lægemiddellevering
- De fleste amerikanere er ikke klar til at genoptage hverdagen uden for hjemmet, Det viser COVID-19 u…
- Konstruere et polymernetværk til at fungere som aktiv camouflage efter behov


