Neutroner kortlægger atomkort over COVID-19s virale replikationsmekanisme

Den første neutronstruktur af SARS-CoV-2-proteasenzymet afslørede uventede elektriske ladninger i aminosyrerne cystein (negativ) og histidin (positiv), at levere nøgledata om virusets replikation. Kredit:Jill Hemman/ORNL, USA's energidepartement
For bedre at forstå, hvordan den nye coronavirus opfører sig, og hvordan den kan stoppes, forskere har afsluttet et tredimensionelt kort, der afslører placeringen af hvert atom i et enzymmolekyle, der er kritisk for SARS-CoV-2-reproduktion.
Forskere ved Department of Energy's Oak Ridge National Laboratory brugte neutronspredning til at identificere nøgleinformation for at forbedre effektiviteten af lægemiddelhæmmere designet til at blokere virusets replikationsmekanisme. Forskningen er offentliggjort i Journal of Biological Chemistry .
SARS-CoV-2-virus, som forårsager COVID-19 sygdommen, udtrykker lange kæder af proteiner sammensat af cirka 1, 900 aminosyrerester. For at virussen kan reproducere sig, disse kæder skal nedbrydes og skæres i mindre tråde af et enzym kaldet hovedproteasen. Det aktive proteaseenzym dannes af to identiske proteinmolekyler, der holdes sammen af hydrogenbindinger. Udvikling af et lægemiddel, der hæmmer eller blokerer proteaseaktiviteten, forhindrer virussen i at replikere og sprede sig til andre celler i kroppen.
"Disse nye oplysninger er præcis, hvad der er nødvendigt for at designe inhibitorer med en højere grad af specificitet, sikre, at inhibitormolekylerne binder meget tæt til deres tilsigtede mål og deaktiverer proteasen, "sagde ORNLs Andrey Kovalevsky, Kontaktforfatter.
Neutronforsøg afslørede først, at stedet, der indeholder aminosyrerne, hvor proteinkæderne skæres, er i en elektrisk ladet reaktiv tilstand og ikke i en hvilende eller neutral tilstand, i modsætning til tidligere antaget tro. Sekund, de kortlagde placeringen af hvert hydrogenatom på de steder, hvor inhibitorer ville binde til proteaseenzymet, samt de tilhørende aminosyrers elektriske ladninger. Eksperimenterne kortlagde også hele netværket af hydrogenbindinger mellem proteinmolekylerne, der holder enzymet sammen og gør det muligt at starte den kemiske proces med at skære proteinkæderne.
"Halvdelen af atomerne i proteiner er brint. Disse atomer er nøglespillere i enzymatisk funktion og er afgørende for, hvordan lægemidler binder, "Sagde Kovalevsky." Hvis vi ikke ved, hvor disse hydrogener er, og hvordan de elektriske ladninger fordeles inde i proteinet, vi kan ikke designe effektive hæmmere for enzymet. "
Teamets neutronundersøgelse bygger på tidligere forskning offentliggjort i tidsskriftet Naturkommunikation , skaber en komplet atomstruktur af proteaseenzymet. Forskerne har også gjort deres data offentligt tilgængelige for det videnskabelige samfund, før begge artikler blev offentliggjort for at fremskynde løsninger på den globale pandemi.
Neutroner er ideelle sonder til at studere biologiske strukturer, fordi de er ikke -destruktive og meget følsomme over for lette elementer som f.eks. Brint. Neutronspredningsforsøgene blev udført ved High Flux Isotope Reactor og Spallation Neutron Source ved ORNL. Proteinprøverne blev syntetiseret i tilstødende faciliteter på Center for Strukturel Molekylær Biologi.
"Dette er muligvis den hurtigste neutronstruktur af et protein, der nogensinde er produceret. Vi startede neutronforsøg i maj, og inden for fem måneder, vi opnåede og offentliggjorde vores resultater. Det er noget, der normalt tager år, "sagde ORNL tilsvarende forfatter Leighton Coates." Dette arbejde viser, hvad vi kan gøre på Oak Ridge. Alt blev gjort her fra start til slut. Proteinerne blev udtrykt, renset, og krystalliseret, og alle data blev indsamlet og analyseret på stedet - en helt lodret integreret tilgang. "
Teamet vil nu bruge de nyligt indhentede oplysninger til at undersøge bindingsegenskaberne for lægemiddelmolekylkandidater til at producere forbedrede COVID-19-terapier.
"Ikke alene er det første gang, nogen har opnået en neutronstruktur af et coronavirus -protein, men det er også første gang nogen har set på denne klasse af proteaseenzymer ved hjælp af neutroner, "sagde ORNLs Daniel Kneller, undersøgelsens første forfatter. "Det er et fremragende eksempel på neutronkrystallografi, der tjener samfundet, når det har mest brug for det."
Sidste artikelUltrahøje præcisionspolymerer
Næste artikelUndersøgelse viser, hvordan små rum kunne have været forud for celler
 Varme artikler
Varme artikler
-
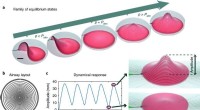 Ved at kombinere pneumatik med en hydrogel for at skabe en baromorf - til blød robotteknologien, Kontinuerlig familie af ligevægtstilstande opnået for en baromorf under forskellige tryk. b, Tilsvarende netværk af kanaler indlejret i pladen. Kanaler er mere koncentrerede i den centrale region
Ved at kombinere pneumatik med en hydrogel for at skabe en baromorf - til blød robotteknologien, Kontinuerlig familie af ligevægtstilstande opnået for en baromorf under forskellige tryk. b, Tilsvarende netværk af kanaler indlejret i pladen. Kanaler er mere koncentrerede i den centrale region -
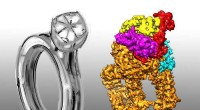 Team rapporterer diamantringarkitektur af et proteinkompleksNuA4 cryo-EM-strukturen ligner en diamantring. Kredit:USTC NuA4/Tip60, et kompleks med diamantringarkitektur, er påkrævet for lovgivnings- og reparationsprocesser. Prof. CAI Gang og Prof. Jacques
Team rapporterer diamantringarkitektur af et proteinkompleksNuA4 cryo-EM-strukturen ligner en diamantring. Kredit:USTC NuA4/Tip60, et kompleks med diamantringarkitektur, er påkrævet for lovgivnings- og reparationsprocesser. Prof. CAI Gang og Prof. Jacques -
 Fem eksempler på salte til Science ClassDet lille hvide krystallinske stof, du drysser på dine pommes frites, er bare et eksempel på, hvad kemikere kalder salte. Faktisk er ethvert ionisk molekyle lavet af en syre og en base, der opløses i
Fem eksempler på salte til Science ClassDet lille hvide krystallinske stof, du drysser på dine pommes frites, er bare et eksempel på, hvad kemikere kalder salte. Faktisk er ethvert ionisk molekyle lavet af en syre og en base, der opløses i -
 Selvhelbredende cement kan forvandle geotermisk industriPNNL-kemiker Carlos Fernandez og et team af forskere har udviklet en selvhelbredende cement, der kan transformere den geotermiske energiindustri. Kredit:Environmental Molecular Sciences Laboratory
Selvhelbredende cement kan forvandle geotermisk industriPNNL-kemiker Carlos Fernandez og et team af forskere har udviklet en selvhelbredende cement, der kan transformere den geotermiske energiindustri. Kredit:Environmental Molecular Sciences Laboratory
- Social udstødelse, karrierebegrænsninger hindrer LGBTQ STEM-professionelle
- En snurrende komet observeres hurtigt at sænke farten under tæt tilnærmelse til Jorden
- Sådan fjernes Silver Plating
- Dom afsagt i MtGox bitcoin underslæbssag
- Begrænsning af tab af natur
- Japan skaber det første kunstige krater på asteroiden


