Forskere omdanner metan til methanol ved stuetemperatur
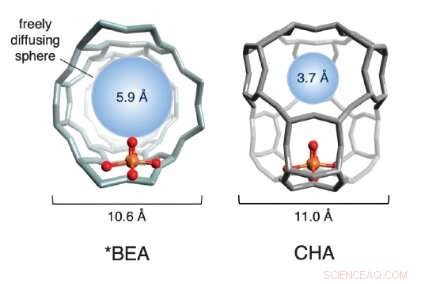
En illustration af burstrukturerne af to jernbaserede zeolitter brugt i undersøgelsen. De røde og guldkugler (der repræsenterer ilt og jern, henholdsvis) udgør det aktive websted. burets struktur, i gråt, er dannet af silicium, aluminium og oxygen. Den blå kugle kvantificerer størrelsen af det største molekyle, der kan diffundere frit ind og ud af buret på det aktive sted (diameteren af metan er ~4,2 Å). Kredit:Benjamin Snyder
Et team af forskere fra Stanford University og University of Leuven i Belgien har yderligere belyst en spændende proces, der kunne være et vigtigt skridt mod en methanol brændstoføkonomi med rigeligt metan som råmateriale, et fremskridt, der fundamentalt kan ændre, hvordan verden bruger naturgas.
Methanol - den enkleste alkohol - bruges til at lave forskellige produkter, som maling og plastik, og som tilsætningsstof til benzin. Rig på brint, methanol kan drive new-age brændselsceller, der kan give betydelige miljømæssige fordele.
Hvis naturgas, hvoraf metan er den primære komponent, kunne omdannes økonomisk til methanol, det resulterende flydende brændstof ville være meget lettere at opbevare og transportere end naturgas og ren brint. Det ville også i høj grad reducere emissionerne af metan fra naturgasbehandlingsanlæg og rørledninger. I dag, undslippet metan, en drivhusgas mange gange stærkere end kuldioxid, ophæver næsten de miljømæssige fordele ved naturgas frem for olie og kul. Holdets nye undersøgelse i den aktuelle udgave af Videnskab er deres seneste til at fremme en lavenergi måde at fremstille methanol fra metan på.
"Denne proces bruger almindelige krystaller kendt som jernzeolitter, der er kendt for at omdanne naturgas til methanol ved stuetemperatur, " forklarer Benjamin Snyder, som fik sin doktorgrad ved Stanford, hvor han studerede katalysatorer for at adressere nøglefacetter af denne udfordring. "Men, dette er ekstremt udfordrende kemi at opnå på et praktisk niveau, da metan er stædigt kemisk inert."
Når metan infunderes i porøse jernzeolitter, methanol produceres hurtigt ved stuetemperatur uden behov for yderligere varme eller energi. Til sammenligning, den konventionelle industrielle proces til fremstilling af methanol ud fra metan kræver temperaturer på 1000°C (1832°F) og ekstremt højt tryk.
"Det er en økonomisk fristende proces, men det er ikke så nemt. Væsentlige barrierer forhindrer opskalering af denne proces til industrielt niveau, " sagde Edward Solomon, Stanford professor i kemi og fotonvidenskab ved SLAC National Accelerator Laboratory. Solomon er seniorforfatter til den nye undersøgelse.
Holder zeolitterne på
Desværre, de fleste jernzeolitter deaktiveres hurtigt. Ude af stand til at behandle mere metan, processen forsvinder. Forskere har været ivrige efter at studere måder at forbedre jernzeolit-ydeevnen på. Den nye undersøgelse, medforfatter af Hannah Rhoda, en Stanford doktorgradskandidat i uorganisk kemi, bruger avanceret spektroskopi til at udforske den fysiske struktur af de mest lovende zeolitter til metan-til-methanol produktion.

Hannah Rhoda med resonans Raman spektroskopiudstyr, som skyder en laser ind i en prøve for at opnå vibrationsinformation fra det nøjagtige sted, der undersøges. Forskere i den aktuelle undersøgelse brugte denne teknik til at hjælpe med at tildele Fe(III)-OH og Fe(III)OCH3 forgiftede steder, som oplyste mekanismen. Kredit:Hannah Rhoda
"Et nøglespørgsmål her er, hvordan man får methanolen ud uden at ødelægge katalysatoren, " sagde Rhoda.
At vælge to attraktive jernzeolitter, holdet studerede den fysiske struktur af gitrene omkring jernet. De opdagede, at reaktiviteten varierer dramatisk afhængigt af størrelsen af porerne i den omgivende krystalstruktur. Holdet omtaler det som "bureffekten, ", da indkapslende gitter ligner et bur.
Hvis porerne i burene er for store, det aktive sted deaktiveres efter blot én reaktionscyklus og genaktiveres aldrig igen. Når poreåbningerne er mindre, imidlertid, de koordinerer en præcis molekylær dans mellem reaktanterne og de aktive jernsteder - en, der direkte producerer methanol og regenererer det aktive sted. Udnyttelse af denne såkaldte 'bureffekt' ' teamet var i stand til at genaktivere 40 procent af de deaktiverede steder gentagne gange - et betydeligt konceptuelt fremskridt hen imod en katalytisk proces i industriel skala.
"Katalytisk cykling - den kontinuerlige reaktivering af regenererede steder - kan en dag føre til kontinuerlige, økonomisk methanolproduktion fra naturgas, " sagde Snyder, nu postdoc ved UC-Berkeley i Institut for Kemi under Jeffrey R. Long.

Benjamin Snyder (til højre) og hans tidligere ph.d.-rådgiver, Edward Solomon, professor i kemi ved Stanford og i fotonvidenskab ved SLAC. Kredit:Linda A. Cicero
Dette grundlæggende skridt fremad i grundlæggende videnskab vil hjælpe med at belyse for kemikere og kemiingeniører den proces, jernzeolitter bruger til at producere methanol ved stuetemperatur, men der er meget arbejde tilbage, før en sådan proces kan blive industrialiseret.
Næste på Snyders liste:tackling af opnåelse af processen ikke kun ved stuetemperatur, men ved hjælp af omgivende luft i stedet for en anden iltkilde, såsom lattergas brugt i disse forsøg. Beskæftiger sig med et kraftigt oxidationsmiddel som oxygen, som er notorisk svært at kontrollere i kemiske reaktioner, vil være endnu en betydelig forhindring på vejen.
For nu, Snyder var både glad og forbløffet over de illustrative kræfter i den sofistikerede spektroskopiske instrumentering i Salomons laboratorier, som blev udnyttet til denne undersøgelse. Disse var uvurderlige for hans forståelse af kemien og de kemiske strukturer involveret i metan-til-methanol-processen.
"Det er fedt, hvordan du kan få meget kraftfuld indsigt på atomniveau, ligesom bur-effekten, fra disse værktøjer, der ikke var tilgængelige for tidligere generationer af kemikere, " sagde Snyder.
 Varme artikler
Varme artikler
-
 Nedbrydelige belægninger til komposterbar papiremballage til fødevarer blokerer fedt og olieKredit:Unsplash/CC0 Public Domain Kopper, kartoner og madindpakninger lavet af papir kan virke som om de ville være biologisk nedbrydelige, men mange indeholder en plastbelægning, der ikke kan kom
Nedbrydelige belægninger til komposterbar papiremballage til fødevarer blokerer fedt og olieKredit:Unsplash/CC0 Public Domain Kopper, kartoner og madindpakninger lavet af papir kan virke som om de ville være biologisk nedbrydelige, men mange indeholder en plastbelægning, der ikke kan kom -
 Selvsortering gennem molekylære geometrierStrukturer af søjle [n] arenaer, n =5 og 6. Venstre, blå:kationiske (positivt ladede) varianter; ret, rød:anioniske (negativt ladede) varianter. Kredit:Kanazawa University Forskere ved Kanazawa Un
Selvsortering gennem molekylære geometrierStrukturer af søjle [n] arenaer, n =5 og 6. Venstre, blå:kationiske (positivt ladede) varianter; ret, rød:anioniske (negativt ladede) varianter. Kredit:Kanazawa University Forskere ved Kanazawa Un -
 Big data og syntetisk kemi kan bekæmpe klimaændringer og forureningLaura Murdock, en ph.d.-kandidat ved University of South Carolina, viser en polymerfilm, hun har lavet efter et kemisk design foreskrevet af maskinlæring. Filmen klarede sig bedre end alle kendte memb
Big data og syntetisk kemi kan bekæmpe klimaændringer og forureningLaura Murdock, en ph.d.-kandidat ved University of South Carolina, viser en polymerfilm, hun har lavet efter et kemisk design foreskrevet af maskinlæring. Filmen klarede sig bedre end alle kendte memb -
 Forskere validerer den kliniske gennemførlighed for CRISPR-baseret COVID-19-test på plejestedetEt farvet scanningselektronmikrografi af SARS-CoV-2 virus. Kredit:NIAID I marts, forskere i Institut for Biomedicinsk Teknik - en delt afdeling i tandlægeskolerne, Medicin, og Engineering - begynd
Forskere validerer den kliniske gennemførlighed for CRISPR-baseret COVID-19-test på plejestedetEt farvet scanningselektronmikrografi af SARS-CoV-2 virus. Kredit:NIAID I marts, forskere i Institut for Biomedicinsk Teknik - en delt afdeling i tandlægeskolerne, Medicin, og Engineering - begynd
- NASAs Mars 2020 får HD-øjne
- Det er (ikke) kompliceret:Venners forhold til venner kan være enklere, end de ser ud til
- Forskere beviser stabiliteten af vidundermaterialet silicen
- Anvendelserne til elektroplettering
- Musikk Effekt på Koncentration som et Science Project
- FORKLARER:Hvad har den japanske rummission udrettet?


