Forskere rapporterer biosyntetisk vej af mechercharmycin A
For nylig, TANG Gonglis gruppe fra Shanghai Institute of Organic Chemistry og University of Chinese Academy of Sciences rapporterede om den biosyntetiske vej for mechercharmycin A (MCM-A), et marint naturprodukt, der tilhører en familie af polyazolcyclopeptider med bemærkelsesværdige bioaktiviteter og unikke strukturer.
Undersøgelsen blev offentliggjort i Cellekemisk biologi den 1. sept.
Gennem bioinformatik analyse og strukturel analyse af MCM-A, forskerne antog, at forbindelsen er et naturligt produkt af ribosomalt syntetiserede og post-translationelt modificerede peptider (RiPP'er).
De sekventerede genomet fra MCM-producenten, Thermoactinomyces sp. YM3-251, søgte i genomdataene med den forudsagte kernesekvens (FIVSSSCS), og identificerede en kandidat biosyntetisk genklynge BGC (mcm) indeholdende det mulige precursorgen mcmA og et dehydratasegen mcmL.
Da den oprindeligt producerende stamme Thermoactinomyces sp. YM3-251 er svær at genetisk manipulere, forskerne fik den formodede BGC (mcmA-mcmL) til heterologt udtryk i Bacillus subtilis 168 for at undersøge den biosyntesevej.
Efter aktivering af BGC ved at tilføje en stærk promotor pLaps, de påviste målproduktet MCM-A i fermenteringsprodukterne. Baseret på dette heterologe udtrykssystem, to MCM-A-analoger (17 og 18) med sammenlignelig antitumoraktivitet blev genereret ved at manipulere den biosyntetiske vej.
På grund af nedbrydningen af precursor-peptiderne i den heterologe ekspressionsvært, hver knockout-mutantstamme (inaktivering af genet mcmA-mcmL) gav ikke flere oplysninger om mellemprodukter eller modifikation af precursor-peptid. Forskerne udførte kombinatorisk samproduktion af precursor-peptidet med forskellige modificerende enzymer i Escherichia coli, hvilket førte til identifikation af en anden timing af ændringer, viser, at et tRNA
Glu
-afhængig meget regioselektiv dehydrering er det første modifikationstrin, efterfulgt af polyazoldannelse gennem heterocyklisering og dehydrogenering i en N- til C-terminal retning.
 Varme artikler
Varme artikler
-
 High-throughput platform muliggør aktivitetskortlægning af nye kræftlægemålEn lysin -methyltransferase fastgjort til et substrat. Den tændte del viser en methylgruppe, der tilsættes af methyltransferasen. Kredit:Dr. Bradley Dickson/Rothbart Laboratory ved Van Andel Research
High-throughput platform muliggør aktivitetskortlægning af nye kræftlægemålEn lysin -methyltransferase fastgjort til et substrat. Den tændte del viser en methylgruppe, der tilsættes af methyltransferasen. Kredit:Dr. Bradley Dickson/Rothbart Laboratory ved Van Andel Research -
 Kubeformede jern-svovl-klynger understøtter multiple bindinger mellem jern og nitrogenKredit:Wiley I en række biologiske processer, jern-svovlklynger spiller en afgørende rolle, hvor de fungerer som cofaktorer til enzymer. Forskning offentliggjort i Angewandte Chemie viser nu, at
Kubeformede jern-svovl-klynger understøtter multiple bindinger mellem jern og nitrogenKredit:Wiley I en række biologiske processer, jern-svovlklynger spiller en afgørende rolle, hvor de fungerer som cofaktorer til enzymer. Forskning offentliggjort i Angewandte Chemie viser nu, at -
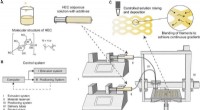 Additiv fremstilling af cellulosebaserede materialer med kontinuerlig, stigninger i flere retningerSkema af fremstillingsprocessen til udskrivning af kontinuerlige gradienter. (A) Skematisk fremstilling af udskrivningsløsninger. Hydroxyethylcellulose (HEC) i pulverform opløses i vand og blandes med
Additiv fremstilling af cellulosebaserede materialer med kontinuerlig, stigninger i flere retningerSkema af fremstillingsprocessen til udskrivning af kontinuerlige gradienter. (A) Skematisk fremstilling af udskrivningsløsninger. Hydroxyethylcellulose (HEC) i pulverform opløses i vand og blandes med -
 Hvordan forlænger man smøremidlernes brugstid?Uanset om det er i din bil eller en vindmølle, skum nedbryder det smøremiddel, der er nødvendigt for, at motorer kan arbejde effektivt. Kredit:Pixabay/phtorxp Vindmøller, der rager flere hundrede
Hvordan forlænger man smøremidlernes brugstid?Uanset om det er i din bil eller en vindmølle, skum nedbryder det smøremiddel, der er nødvendigt for, at motorer kan arbejde effektivt. Kredit:Pixabay/phtorxp Vindmøller, der rager flere hundrede
- Første lys til stormjægeren
- Yamaha Kt100 Go-Kart Engine Specifikationer
- Forbedring af den piezoelektriske mikroskopi karakterisering af keramiske materialer
- Er du en klimahykler? Her er hvorfor du ikke skal bekymre dig
- Sådan Shock a Pond til at bestemme mængden af Fish
- Hvordan skoler kan fremme borgerlig diskussion i en tidsalder med incivilitet


