Et generelt kemisk princip til at skabe lukkestabiliserende integrinhæmmere
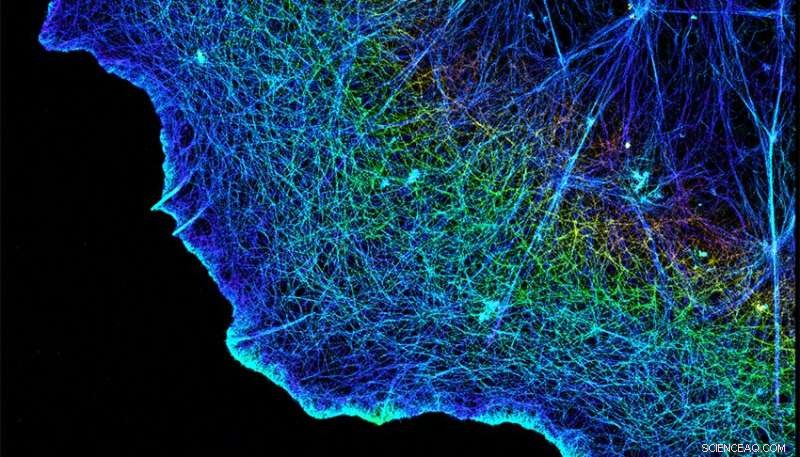
Integriner forbinder cellernes fibrøse cytoskeletter, vist her, med matrixen, der omgiver dem. Kredit:Xiaowei Zhuang/HHMI/Harvard University/Nature Publishing Group
Nævn en biologisk funktion, og proteiner kaldet integriner er sandsynligvis involveret i den.
Sammen tillader de 24 medlemmer af integrinfamilien celler at binde sig til hinanden og til matrixen, der omgiver dem. De hjælper celler med at beslutte, hvad de skal blive, hvor de skal hen, hvordan de reagerer på deres omgivelser, og hvornår de skal vokse, dele sig eller dø.
Integrins allestedsnærværende og alsidighed betyder også, at når celler, der bærer dem, går skævt, kan disse proteiner bidrage til en række sygdomme, fra autoimmune sygdomme til kræft.
FDA har indtil videre godkendt seks lægemidler, der reducerer aktiviteten af specifikke integriner til behandling af sygdomme som multipel sklerose og colitis ulcerosa og for at forhindre dannelse af blodpropper. Til skuffelse for videnskabsmænd, læger og patienter har andre lovende kandidater imidlertid fejlet i kliniske forsøg og indskrænket integriners potentiale som behandlingsmål.
Nyt arbejde ledet af forskere ved Harvard Medical School og Boston Children's Hospital afslører en årsag til fejlene – og tilbyder en potentiel løsning.
Timothy Springer, Latham-familieprofessor i biologisk kemi og molekylær farmakologi ved HMS og Boston Children's, og hans kolleger, kiggede nærmere på et integrin involveret i blodkoagulering, og hans kolleger fandt ud af, at mislykkede lægemidler til to forskellige integriner utilsigtet tilskyndede integrinerne til at åbne sig ind i deres "on" position, hvilket potentielt driver integrin-aktivitet i stedet for at dæmpe den.
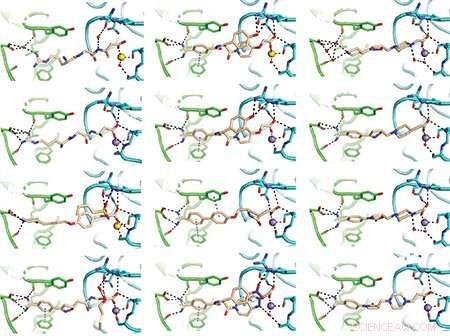
Holdet gjorde nogle af sine opdagelser ved hjælp af røntgenkrystallografi, en omhyggelig metode til at bestemme proteiners molekylære strukturer. Disse er nogle af de resulterende diagrammer af lægemidler bundet til det koagulerede integrin. Billeder:Fu-Yang Lin, Jing Li, Yonghua Xie, et al., Cell
Holdet afslørede, at i sin lukkede eller "slukkede" position indeholder integrinet et vandmolekyle, der holdes på plads af en række kemiske bindinger. Integrinet udstøder vandmolekylet, når det aktiveres.
Da de havde lært, hvad der skete, var forskerne i stand til at designe integrinblokkere, der lokkede koagulationsproteinet til dets "off"-position ved at holde vandmolekylet på plads med et nitrogenatom.
Yderligere test antydede, at vandmolekyler spiller den samme rolle i andre integriner, hvilket indikerer, at holdets strategi kunne fungere bredere.
Resultaterne, offentliggjort i tidsskriftet Cell den 15. september, slå en klarere vej for udvikling af lægemidler og uddybe forskernes forståelse af, hvordan integriner fungerer normalt.
"Det samme designprincip for vandudnyttelse er allerede blevet udvidet til et andet integrin, og strukturelle oplysninger tyder på, at forskere kan designe lægemidler til at målrette yderligere medlemmer af integrinfamilien for at behandle sygdomme, der forårsager stor lidelse," sagde Springer, som er medlem af programmet i cellulær og molekylær medicin ved Boston Children's.
"Det er altid glædeligt at arbejde på et projekt, der er både videnskabeligt og medicinsk vigtigt," tilføjede han. + Udforsk yderligere
Proteiner holder greb om cellerne
 Varme artikler
Varme artikler
-
 <p> Som et naturligt forekommende organisk opløsningsmiddel, der ofte bruges til fremstilling af pl…væsken med en tør, hvid absorberende klud. Skrap forsigtigt halvfaststoffer med en afrundet ske. Opbryd faste stoffer og brug en støvsuger til at fjerne dem helt. Bland opløsningen Bland 1/4 tsk
<p> Som et naturligt forekommende organisk opløsningsmiddel, der ofte bruges til fremstilling af pl…væsken med en tør, hvid absorberende klud. Skrap forsigtigt halvfaststoffer med en afrundet ske. Opbryd faste stoffer og brug en støvsuger til at fjerne dem helt. Bland opløsningen Bland 1/4 tsk -
 Depression, fedme, kroniske smerter kan behandles ved at målrette det samme nøgleproteinEn ny inhibitor (orange) er selektiv for FKBP51, som er involveret i depression, kroniske smerter og fedme. Kredit:Felix Hausch Større depression, fedme og kronisk smerte er alle forbundet med vir
Depression, fedme, kroniske smerter kan behandles ved at målrette det samme nøgleproteinEn ny inhibitor (orange) er selektiv for FKBP51, som er involveret i depression, kroniske smerter og fedme. Kredit:Felix Hausch Større depression, fedme og kronisk smerte er alle forbundet med vir -
 Ny mikroskopteknik afslører indre struktur af levende embryonerEt GLIM billede af et gengivet ko-embryo, der blev skåret gennem midten for at afsløre indre strukturer. Kredit:Billede udlånt af Gabriel Popescu Forskere fra University of Illinois har udviklet e
Ny mikroskopteknik afslører indre struktur af levende embryonerEt GLIM billede af et gengivet ko-embryo, der blev skåret gennem midten for at afsløre indre strukturer. Kredit:Billede udlånt af Gabriel Popescu Forskere fra University of Illinois har udviklet e -
 Naturen har mere end én måde at fremstille metan på, siger biokemikereUtah State University biokemikere, fra venstre, Zhi-Yong Yang, Derek Harris, Rhesa Ledbetter og professor Lance Seefeldt, sammen med samarbejdspartnere fra University of Washington og Montana State Un
Naturen har mere end én måde at fremstille metan på, siger biokemikereUtah State University biokemikere, fra venstre, Zhi-Yong Yang, Derek Harris, Rhesa Ledbetter og professor Lance Seefeldt, sammen med samarbejdspartnere fra University of Washington og Montana State Un
- Hvad er et matchhoved lavet af?
- Quibi har indgået et partnerskab med T-Mobile, da det forbereder lanceringen i april
- Forskere afslører fejlsikker struktur af enzym knyttet til Alzheimers, Kræft
- Forskere afslører nye, stabile 2-D materialer
- Secret of britisk chokoladefremstilling inspirerer til opdagelse af ny laktoseform
- Hvordan bucking klimaforandringer ville hindre kampen mod hiv/aids


