Forskere rapporterer vellykket syntese af specifikke chirale molekyler ved hjælp af omlejringer af simple kulbrinter
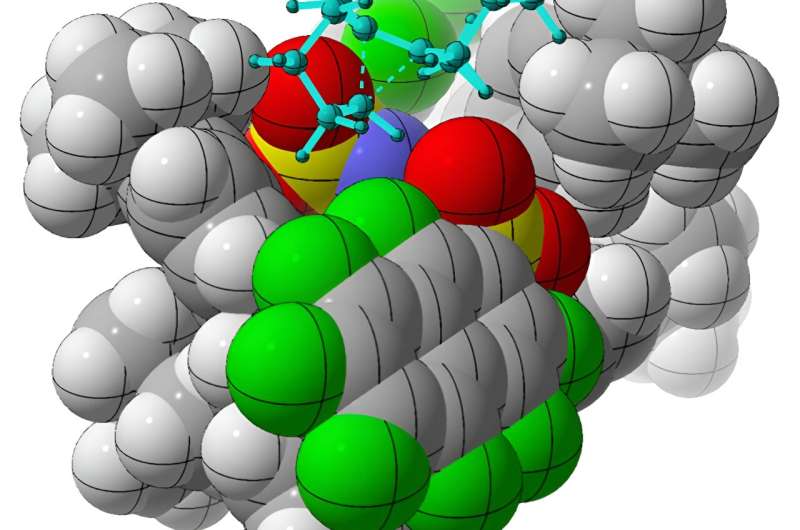
I naturen er organiske molekyler enten venstre- eller højrehåndede, men det er svært at syntetisere molekyler med en specifik "håndhed" i et laboratorium. Lav et lægemiddel eller et enzym med den forkerte "handedness", og det vil bare ikke virke. Nu kommer kemikere ved University of California, Davis, tættere på at efterligne naturens kemiske effektivitet gennem beregningsmodellering og fysiske eksperimenter.
I en undersøgelse, der vises 10. januar i Nature , professor Dean Tantillo, kandidatstuderende William DeSnoo og Croix Laconsay og kolleger ved Max Planck Institute i Tyskland rapporterer om den vellykkede syntese af specifikke chirale ("håndede") molekyler ved hjælp af omlejringer af simple kulbrinter i nærvær af komplekse organiske katalysatorer. De fleste biologiske forbindelser, herunder mange receptpligtige lægemidler, er chirale.
Tantillo og kolleger håber, at resultaterne vil gøre det muligt for forskere bedre at udnytte kulbrinter til en række forskellige formål, såsom forstadier til medicin og materialer.
"Det nye ved dette papir er, at det virkelig er første gang, så vidt jeg ved, at nogen har været i stand til at få et carbonatskifte, der gør det ene af spejlbilledets produkter i stedet for det andet med høj selektivitet," sagde Tantillo.
Små kugler af fedt
I kemi er chiralitet en egenskab, der refererer til et par molekyler, der deler atomart makeup, men er spejlbilleder af hinanden. Ligesom dine venstre og højre hænder kan de ikke lægges oven på hinanden.
"Syntetiske kemikere ønsker ofte at lave molekyler, der kommer i spejlbilleder, men de vil kun have en af dem," sagde Tantillo. "For eksempel, hvis du vil lave et lægemiddelmolekyle, har du ofte brug for en af de to chirale former for at binde selektivt til et protein- eller enzymmål."
Det kan være svært at opnå dette i laboratoriemiljøer, fordi sådanne molekyler ifølge Tantillo ofte er som "små kugler af fedt med en positiv ladning smurt rundt om dem."
Den fedtede natur af disse molekyler gør typisk binding af en kemisk katalysator i én orientering frem for en anden vanskelig på grund af manglen på ladede grupper for katalysatoren at gribe fat i.
Men forskerne fandt en løsning. Ved at bruge en chiral organisk syre, imidodiphosphorimidat, som katalysator, udførte holdet med succes omlejringer af achirale alkenylcycloalkaner, hvilket producerede chirale molekyler af interesse kaldet cycloalkener. Ved hjælp af beregningsmetoder udledte Tantillo og kolleger, hvordan katalysatoren selektivt producerer den ene chirale form frem for den anden.
Ligheder med naturen
Tantillo sagde, at den resulterende reaktion ligner, hvordan enzymer, der laver kulbrinteprodukter kaldet terpener, opfører sig i naturen. En del af Tantillos forskning vedrører kortlægning af terpenreaktionsveje ved hjælp af kvantemekaniske metoder.
"Hvis der er flere mulige veje til et produkt, så har du, hver gang du stopper ved et mellemprodukt på den vej, mulighed for at få biprodukter, der kommer fra det mellemprodukt," sagde han. "Så det er vigtigt at vide, hvornår og hvorfor en carbocation ønsker at stoppe undervejs til en given terpen, hvis man ønsker at forstå og i sidste ende re-konstruere terpen-dannende enzymer."
Den nye metode kunne i princippet udnyttes til at producere både naturlige molekyler og ikke-naturlige molekyler.
"Om disse ting nogensinde vil blive gjort er svært at sige, men petroleum er en kilde til en masse kulbrinter, og hvis du katalytisk kunne omdanne dem til molekyler med defineret chiralitet, har du øget værdien af disse molekyler," sagde Tantillo. .
Yderligere medforfattere er:Vijay Wakchaure, Markus Leutzsch og Benjamin List, Max Planck Institut für Kohlenforschung, Mülheim an der Ruhr, Tyskland; og Nobuya Tsuji, Hokkaido University, Sapporo, Japan.
Flere oplysninger: Vijay N. Wakchaure et al., Katalytiske asymmetriske kationiske skift af alifatiske kulbrinter, Nature (2024). DOI:10.1038/s41586-023-06826-7
Journaloplysninger: Natur
Leveret af UC Davis
 Varme artikler
Varme artikler
-
 En ny strategi til at skabe blåt lys fra et lovende materialeSkemaet for syntesen af EDBESO4 behandlet CsPbBr3 NPLer. Kredit:Avancerede energimaterialer DOI:10.1002/aenm.202201605 Et forskningshold fra Florida State University har udviklet en ny måde at sk
En ny strategi til at skabe blåt lys fra et lovende materialeSkemaet for syntesen af EDBESO4 behandlet CsPbBr3 NPLer. Kredit:Avancerede energimaterialer DOI:10.1002/aenm.202201605 Et forskningshold fra Florida State University har udviklet en ny måde at sk -
 Kemikere rapporterer om en ny anvendelse af affaldsproduktet fra atomkraftproduktionKredit:CC0 Public Domain Kemikere har fundet en ny anvendelse for affaldsproduktet fra atomkraft - ved at omdanne et ubrugt lager til en alsidig forbindelse, som kan bruges til at skabe værdifulde
Kemikere rapporterer om en ny anvendelse af affaldsproduktet fra atomkraftproduktionKredit:CC0 Public Domain Kemikere har fundet en ny anvendelse for affaldsproduktet fra atomkraft - ved at omdanne et ubrugt lager til en alsidig forbindelse, som kan bruges til at skabe værdifulde -
 Hvor skadelige er nano-kobber og svampedræbende kombinationer i vandvejene?Feltprøveindsats, hvor intakte bentiske samfundskerner blev indsamlet. Kredit:Kay Ho En nyligt offentliggjort artikel i Miljøtoksikologi og kemi , Virkninger af mikroniseret og nano-kobberazol p
Hvor skadelige er nano-kobber og svampedræbende kombinationer i vandvejene?Feltprøveindsats, hvor intakte bentiske samfundskerner blev indsamlet. Kredit:Kay Ho En nyligt offentliggjort artikel i Miljøtoksikologi og kemi , Virkninger af mikroniseret og nano-kobberazol p -
 Team udvikler maskine med det formål at stoppe tekstilaffaldFra venstre, Emelie Kamera ’17, Anil Netravali, Jean &Douglas McLean -professoren i fibervidenskab og beklædningsdesign, Tasha Lewis, assisterende professor i fibervidenskab og beklædningsdesign, og S
Team udvikler maskine med det formål at stoppe tekstilaffaldFra venstre, Emelie Kamera ’17, Anil Netravali, Jean &Douglas McLean -professoren i fibervidenskab og beklædningsdesign, Tasha Lewis, assisterende professor i fibervidenskab og beklædningsdesign, og S
- Hvad ligger bag Kinas rekordoversvømmelser?
- Sådan finder du et talemønster
- Trafikken er dramatisk undervurderet som den største forurener af nitrogenoxid
- Hvem holder elbiler tilbage i Australien? Vi har længe kendt svaret, og det er tid til at rydde vej…
- Analyse af Baltimore Citys bymæssige gårde og haver finder sikre metalleniveauer på langt de fles…
- Eksperiment afslører strategisk tænkning hos mus


