Forskere udvikler irreversibel inhibitor til at adressere proteiner, der har erhvervet lægemiddelresistente mutationer
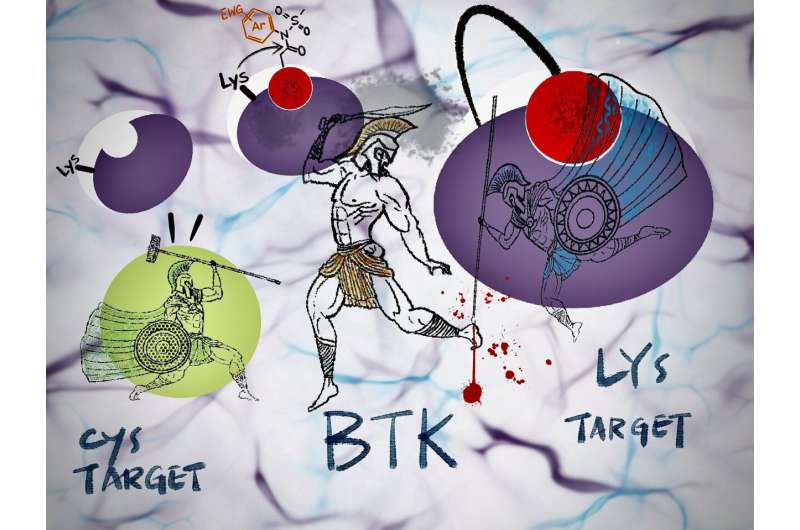
Ideen om irreversible inhibitorer, der klæber permanent til et målprotein, har fået stigende opmærksomhed for anvendelse i potentiel lægemiddeludvikling. En af mange forhindringer er imidlertid muligheden for proteinmutationer, der gør ellers effektive lægemidler farmakologisk inaktive.
Nuværende kovalente inhibitorer har reaktive grupper, der vides at inducere en enkelt reaktion i målproteiner, hvilket irreversibelt slår dem fra. Nogle gange kan mutationer dog lettere forekomme med specifikke aminosyrer, hvilket forstyrrer denne deaktivering.
Nu har et team af forskere ved Kyoto University udviklet en ny reaktant, der viser effektivitet på proteiner, der har erhvervet lægemiddelresistente mutationer.
"I Bruton-type tyrosinkinase (BTK), et vigtigt lægemiddelmål, er en mutation, der involverer aminosyrer cystein til serin - kaldet C481S - kendt, men vi har endnu ikke set nogen for vores lysinmål," bemærker Tomonori Tamura fra Graduate Ingeniørskolen.
"Alligevel er det væsentligt, at vores irreversible inhibitor i det mindste kan løse C481S-problemet," tilføjer Tamura.
Konventionelle irreversible inhibitorer, der anvendes i klinisk praksis, reagerer kun med protein-cysteinrester.
Derudover er cystein - det mest reaktive blandt de 20 aminosyrer - ikke rigeligt på reaktions- eller bindingssteder. Denne aminosyre kan muteres til en anden aminosyre, hvilket gør de cystein-målrettede irreversible inhibitorer ineffektive over for lægemiddelresistente proteiner.
I modsætning hertil kan N-acyl-N-arylsulfonamid eller ArNASA reagere med lysinrester og er meget stabilt i serumholdige medier og andre fysiologiske miljøer.
"Ved at bruge denne reaktionsegenskab udviklede vi den første irreversible inhibitor af BTK, som har lægemiddelresistente mutationer," tilføjer Tamura.
Tamura-holdets jagt på nyttige reaktive grupper kan komme til at lykkes med ArNASA. Det er vigtigt, at dets elektrofiler fjerner begrænsende faktorer ved at minimere hydrolytisk inaktivering og utilsigtede reaktioner med off-target proteiner.
Når først målet engagerer sig med den irreversible inhibitor, reagerer den reaktive gruppe kemisk med proteinets aminosyrer for at danne en kovalent binding. Et uophørligt bindingssted resulterer, som irreversibelt hæmmer proteinaktivitet.
Tamuras team forbedrede en tidligere NASA-gruppe - svarende i effektivitet som ArNASA, men ineffektiv i serumholdige medier - ved at syntetisere den nye reaktive gruppe ved hjælp af aromatiske aminer som udgangsmaterialer. Forskerne anvendte ArNASA-gruppen til BTK, et vigtigt terapeutisk mål for blodkræft, såsom kronisk lymfatisk leukæmi.
"Vores undersøgelse vil strække sig ud over cellebaseret forskning til in vivo og bane vejen for udvikling af lægemidler med forskellige reaktantgrupper, der virker på specifikke aminosyrer," konkluderer Tamura.
Forskningen er offentliggjort i Journal of the American Chemical Society .
Flere oplysninger: Masaharu Kawano et al., Lysine-Reactive N-Acyl-N-aryl Sulfonamide Warheads:Improved Reaction Properties and Application in the Covalent Inhibition of an Ibrutinib-Resistant BTK Mutant, Journal of the American Chemical Society (2023). DOI:10.1021/jacs.3c08740
Journaloplysninger: Tidsskrift for American Chemical Society
Leveret af Kyoto University
 Varme artikler
Varme artikler
-
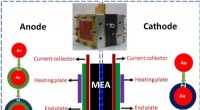 Forskere udvikler selektive elektrokatalysatorer for at øge ydeevnen for brændselsceller i methano…DMFC -samlinger. Skematisk illustration, der viser en DMFC fremstillet med selektive elektrokatalysatorer ved anode- og katodekamrene. Indløb er fotografiet af den samlede celle. Kredit:YANG jun E
Forskere udvikler selektive elektrokatalysatorer for at øge ydeevnen for brændselsceller i methano…DMFC -samlinger. Skematisk illustration, der viser en DMFC fremstillet med selektive elektrokatalysatorer ved anode- og katodekamrene. Indløb er fotografiet af den samlede celle. Kredit:YANG jun E -
 Hvor tydeligere rapportering af negative eksperimentelle resultater ville forbedre reaktionsplanlæg…Kredit:Angewandte Chemie Databaser indeholdende enorme mængder eksperimentelle data er tilgængelige for forskere på tværs af en lang række kemiske discipliner. Et team af forskere har imidlertid op
Hvor tydeligere rapportering af negative eksperimentelle resultater ville forbedre reaktionsplanlæg…Kredit:Angewandte Chemie Databaser indeholdende enorme mængder eksperimentelle data er tilgængelige for forskere på tværs af en lang række kemiske discipliner. Et team af forskere har imidlertid op -
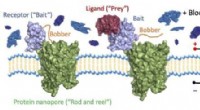 Forskere udvikler molekylær fiskeri for at finde individuelle molekyler i blodDenne figur illustrerer en protein-nanopore-baseret sensor til påvisning af proteiner i en kompleks biologisk væske ved enkeltmolekylær præcision. På venstre side, sensoren, som er et konstrueret tran
Forskere udvikler molekylær fiskeri for at finde individuelle molekyler i blodDenne figur illustrerer en protein-nanopore-baseret sensor til påvisning af proteiner i en kompleks biologisk væske ved enkeltmolekylær præcision. På venstre side, sensoren, som er et konstrueret tran -
 Video:Kemien ved madlavningKredit:The American Chemical Society Voldsomme køkkengadgets som langsomme komfurer og trykkogere fylder meget. Mange mennesker spekulerer måske på, om det er umagen værd at eje så mange glorifice
Video:Kemien ved madlavningKredit:The American Chemical Society Voldsomme køkkengadgets som langsomme komfurer og trykkogere fylder meget. Mange mennesker spekulerer måske på, om det er umagen værd at eje så mange glorifice
- Læs højt for dine børn for at øge deres ordforråd
- Hvordan Alkohol Termometre Arbejde
- Coronavirus:Lytter regeringer nogensinde virkelig til videnskaben?
- Aftagende opmærksomhed på klimaændringer midt i pandemi kan have varige konsekvenser
- Forskere lægger ud med, hvordan man kan kontrollere biologi med lys - uden genetik
- Sådan fungerer korrigerende linser


