Hvorfor er der hydrogenbinding i vand, men ikke saltsyre, selvom begge har brint?
Vandmolekyler (H2O) udviser hydrogenbinding på grund af tilstedeværelsen af et stærkt elektronegativt oxygenatom og to hydrogenatomer. Iltatomet i vand tiltrækker elektroner stærkere end brint, hvilket skaber en delvis negativ ladning (δ-) på ilten og delvise positive ladninger (δ+) på brintatomerne. Denne polaritet gør det muligt for brintatomerne i et vandmolekyle at danne hydrogenbindinger med oxygenatomet i et andet vandmolekyle. Hydrogenbindingerne mellem vandmolekyler resulterer i dannelsen af et sammenhængende netværk, som er ansvarligt for vands unikke egenskaber, såsom dets høje overfladespænding, høje specifikke varmekapacitet og evne til at opløse mange stoffer.
Ingen hydrogenbinding i saltsyre:
Saltsyre (HCl) er en forbindelse sammensat af hydrogen- og kloratomer. I modsætning til vand udviser saltsyre ikke hydrogenbinding. Dette skyldes, at elektronegativitetsforskellen mellem brint og klor ikke er så signifikant som mellem brint og oxygen. Kloratomet i HCl tiltrækker elektroner stærkere end hydrogen, men forskellen i elektronegativitet er ikke tilstrækkelig til at skabe en signifikant delvis ladningsadskillelse og muliggøre hydrogenbinding. Derudover gør tilstedeværelsen af det stærkt elektronegative chloratom i HCl hydrogenatomet mindre tilgængeligt for hydrogenbinding.
Sammenfattende er tilstedeværelsen af stærk hydrogenbinding i vand et resultat af den høje elektronegativitetsforskel mellem oxygen og brint, som muliggør dannelsen af partielle ladninger og de efterfølgende hydrogenbindinger. I modsætning hertil mangler saltsyre signifikant hydrogenbinding på grund af den lavere elektronegativitetsforskel mellem brint og klor.
 Varme artikler
Varme artikler
-
 For at opsnuse kriminalitet og forsvundne personer, videnskaben støtter bloddetektionshundeHunde kan pålideligt opsnuse menneskeblod, selv efter to års miljøforringelse. Kredit:Jason Korbol/shutterstock Det er svært at overveje tragedien ved at miste en elsket en og aldrig vide, hvad de
For at opsnuse kriminalitet og forsvundne personer, videnskaben støtter bloddetektionshundeHunde kan pålideligt opsnuse menneskeblod, selv efter to års miljøforringelse. Kredit:Jason Korbol/shutterstock Det er svært at overveje tragedien ved at miste en elsket en og aldrig vide, hvad de -
 Forskere udvikler en procedure og en billig, hurtig og miljøvenlig enhed, der er i stand til at det…Kredit:Alicante University Alicante Universitets analytiske atomspektrometri forskergruppe ledet af analytisk kemiprofessor Juan Mora Pastor, har udviklet en ny procedure og enhed til at detektere
Forskere udvikler en procedure og en billig, hurtig og miljøvenlig enhed, der er i stand til at det…Kredit:Alicante University Alicante Universitets analytiske atomspektrometri forskergruppe ledet af analytisk kemiprofessor Juan Mora Pastor, har udviklet en ny procedure og enhed til at detektere -
 Populært nyt byggemateriale hjælper med at måle proteinpartiklerProteinpartikler er ikke sfæriske, selvom nogle af de værktøjer, der bruges til at måle dem, er sfæriske. Kredit:Kelly Irvine/NIST Det er vigtigt at forstå, hvordan proteiner klumper sig sammen i
Populært nyt byggemateriale hjælper med at måle proteinpartiklerProteinpartikler er ikke sfæriske, selvom nogle af de værktøjer, der bruges til at måle dem, er sfæriske. Kredit:Kelly Irvine/NIST Det er vigtigt at forstå, hvordan proteiner klumper sig sammen i -
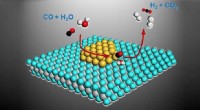 Forskere rykker tættere på brintdrevne bilerEn international forskergruppe, herunder materialeforskere fra Lehigh, har udviklet en guldbaseret katalysator, der omdanner kulilte og vand til en strøm af ren brint og kuldioxid. Kredit:Ding Ma/Peki
Forskere rykker tættere på brintdrevne bilerEn international forskergruppe, herunder materialeforskere fra Lehigh, har udviklet en guldbaseret katalysator, der omdanner kulilte og vand til en strøm af ren brint og kuldioxid. Kredit:Ding Ma/Peki
- Forbedring af sikkerheden, da kunstig intelligens flytter til smartphones
- Hvad er funktionerne af Carbonic Anhydrase?
- Immigration er til gavn for økonomier, selv efter 100 år
- Bør SEC droppe kvartalsrapportering?
- Filmer den termiske død af elektroner i stof
- Boeing 737 MAX og prisen på en flydende flåde


