Hvad er forskellene mellem arrangement af partikler i faste stoffer, væsker og gasser?
Faststoffer:
- Partikler i faste stoffer holdes sammen af stærke intermolekylære kræfter, såsom kovalente bindinger, ionbindinger eller metalliske bindinger.
- Disse kræfter holder partiklerne låst i faste positioner og danner en stiv struktur.
- Partiklerne i faste stoffer vibrerer på plads, men har ikke nok energi til at bevæge sig forbi hinanden.
- Faste stoffer har en bestemt form og volumen, fordi deres partikler er tæt pakket.
Væsker:
- Partikler i væsker holdes sammen af svagere intermolekylære kræfter, såsom dipol-dipol-kræfter, brintbindinger eller London-spredningskræfter.
- Disse kræfter tillader partikler at bevæge sig mere frit og forbi hinanden.
- Væsker tager form af deres beholder, men har et bestemt volumen.
- Partiklerne i væsker er mindre tætpakket sammenlignet med faste stoffer og har mere kinetisk energi, hvilket gør, at de kan bevæge sig mere frit.
Gasser:
- Partikler i gasser har meget svage intermolekylære kræfter eller næsten ingen intermolekylære kræfter.
- Partiklerne i gasser bevæger sig hurtigt og tilfældigt med høj kinetisk energi.
- Gasser har ikke en bestemt form eller volumen og udvider sig for at fylde deres beholder.
- Partiklerne i gasser er stærkt spredte og har meget mellemrum.
Sammenfattende har faste stoffer faste partikelarrangementer med stærke intermolekylære kræfter, væsker har mere bevægelsesfrihed med svagere intermolekylære kræfter, og gasser har meget spredte partikler med meget svage eller ubetydelige intermolekylære kræfter.
 Varme artikler
Varme artikler
-
 Et nyt materiale til fremtidens batteriUCLouvains forskere opdagede et nyt højtydende og sikkert batterimateriale (LTPS), der kan fremskynde opladning og afladning til et niveau, der aldrig er observeret hidtil. Kredit:University of Louvai
Et nyt materiale til fremtidens batteriUCLouvains forskere opdagede et nyt højtydende og sikkert batterimateriale (LTPS), der kan fremskynde opladning og afladning til et niveau, der aldrig er observeret hidtil. Kredit:University of Louvai -
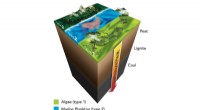 Forskere bruger røntgenstråler til at knække skiferens hemmeligheder, en hjørnesten i en af na…Som vist i denne illustration, som kulstof som det der findes i alger, marine plankton og kystnære landplanter bevæger sig tættere på Jordens kerne, det udsættes for højere temperaturer og tryk, der æ
Forskere bruger røntgenstråler til at knække skiferens hemmeligheder, en hjørnesten i en af na…Som vist i denne illustration, som kulstof som det der findes i alger, marine plankton og kystnære landplanter bevæger sig tættere på Jordens kerne, det udsættes for højere temperaturer og tryk, der æ -
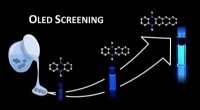 Molekylærbiblioteker for organiske lysdioderEn ny screeningsproces betyder, at lovende OLED -belysningsmaterialer kan identificeres mere effektivt. Kredit:AG Matthias Wagner Den stigende efterspørgsel efter stadig mere sofistikerede smartph
Molekylærbiblioteker for organiske lysdioderEn ny screeningsproces betyder, at lovende OLED -belysningsmaterialer kan identificeres mere effektivt. Kredit:AG Matthias Wagner Den stigende efterspørgsel efter stadig mere sofistikerede smartph -
 Undersøgelse finder beviser for eksistensen af undvigende metabolonKredit:CC0 Public Domain I mere end 40 år, videnskabsmænd har antaget eksistensen af enzymklynger, eller metaboloner, ved at lette forskellige processer i celler. Ved hjælp af en ny billedtekno
Undersøgelse finder beviser for eksistensen af undvigende metabolonKredit:CC0 Public Domain I mere end 40 år, videnskabsmænd har antaget eksistensen af enzymklynger, eller metaboloner, ved at lette forskellige processer i celler. Ved hjælp af en ny billedtekno
- Egenskaber for ash
- Hvorfor skiller brint sig fra hinanden, hvorfor er det af sig selv?
- Ny rapport fortæller dyster historie om varme, tørke og brand i Australien
- Hvad en ubelejlig sandhed fik ret (og forkert) om klimaændringer
- Hustande med solpaneler og batterier har en stor fordel ved at spare penge på elbiler
- Luftspredningsmodeller til lugtvurdering


