Ved at bruge udtrykkene opløst stof og opløsningsmiddel, hvad er forskellen mellem at fortynde en koncentreret opløsning?
For at illustrere, lad os overveje en simpel opløsning af sukker opløst i vand. I en fortyndet sukkeropløsning ville der være en lille mængde sukker opløst i en stor mængde vand. I en koncentreret sukkeropløsning ville der være en stor mængde sukker opløst i en lille mængde vand.
Koncentrationen af en opløsning kan udtrykkes på flere måder, herunder:
- Masse/masseprocent: Dette er massen af opløst stof pr. 100 gram opløsning.
- Masse/volumenprocent: Dette er massen af opløst stof pr. 100 milliliter opløsning.
- Molaritet: Dette er antallet af mol opløst stof pr. liter opløsning.
- Parts per million (ppm): Dette er antallet af dele opløst stof pr. million dele opløsning.
- Parts pr. milliard (ppb): Dette er antallet af dele af opløst stof pr. milliard dele af opløsning.
Valget af koncentrationsenhed afhænger af den specifikke anvendelse. For eksempel er masse/masseprocent almindeligvis brugt til fast-flydende opløsninger, mens masse/volumen procent er almindeligt anvendt til væske-flydende opløsninger. Molaritet bruges ofte til opløsninger brugt i kemiske reaktioner, mens ppm og ppb ofte bruges til meget fortyndede opløsninger.
Sidste artikelHvor mange atomer er der i den kemiske formel H3PO4?
Næste artikelHvad er formen og bindingsvinklen af natriumsulfat?
 Varme artikler
Varme artikler
-
 Klarhed nødvendig i klassificeringssystemer til forarbejdede fødevarerKredit:Pixabay/CC0 Public Domain Nuværende fødevareklassifikationssystemer for forarbejdede fødevarer mangler konsistens og konsensus, der ofte fører til forvirring og debat, selv blandt forskere,
Klarhed nødvendig i klassificeringssystemer til forarbejdede fødevarerKredit:Pixabay/CC0 Public Domain Nuværende fødevareklassifikationssystemer for forarbejdede fødevarer mangler konsistens og konsensus, der ofte fører til forvirring og debat, selv blandt forskere, -
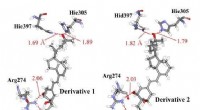 Chiralitet af vitamin D-derivat påvirker protonationstilstandene af dets receptorproteinHydrogenbindingsinteraktioner mellem vitamin-D-derivater og aminosyrerester i VDR; (a) derivat 1 og (b) derivat 2, der har de samme kemiske strukturer, men forskellige chiraliteter. Vores ab initio mo
Chiralitet af vitamin D-derivat påvirker protonationstilstandene af dets receptorproteinHydrogenbindingsinteraktioner mellem vitamin-D-derivater og aminosyrerester i VDR; (a) derivat 1 og (b) derivat 2, der har de samme kemiske strukturer, men forskellige chiraliteter. Vores ab initio mo -
 Egenskaber af katalysatorer studeret med gammastråleresonansKredit:Kazan Federal University Dampstøttede olieudvindingsmetoder til tunge aflejringer har længe været i fokus på Kazan Federal University. I særdeleshed, Der lægges stor vægt på in-situ forbræn
Egenskaber af katalysatorer studeret med gammastråleresonansKredit:Kazan Federal University Dampstøttede olieudvindingsmetoder til tunge aflejringer har længe været i fokus på Kazan Federal University. I særdeleshed, Der lægges stor vægt på in-situ forbræn -
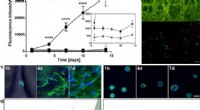 Engineering ECM-lignende fibre med bioaktiv silke til 3-D cellekulturSpredning og udvidelse af celler i FN-silke sammenlignet med når de er indkapslet i en RGD-koblet hydrogel. (a) repræsentativ graf (middelværdi og standardafvigelse) for Alamar Blue-levedygtighedsassa
Engineering ECM-lignende fibre med bioaktiv silke til 3-D cellekulturSpredning og udvidelse af celler i FN-silke sammenlignet med når de er indkapslet i en RGD-koblet hydrogel. (a) repræsentativ graf (middelværdi og standardafvigelse) for Alamar Blue-levedygtighedsassa
- The Game Awards:højdepunkterne, premiere og vindere ved videospilindustrien store aften
- En hidtil uset karakter af ekstreme oversvømmelser i det nordvestlige England afsløret
- Forskere får indsigt i et fysisk fænomen, der fører til jordskælv
- NASA ser en styrkelse af den tropiske storm Gert vest for Bermuda
- Diversificering i forsyningskæden er afgørende for at undgå fødevarechok i byer
- Hvordan veje kan hjælpe med at afkøle sydende byer


