Hvilke egenskaber deler alle polære molekyler?
1. Debiteringsadskillelse :Polære molekyler har en ladningsadskillelse, hvilket betyder, at de har en positiv ende og en negativ ende. Denne adskillelse af ladning skaber et dipolmoment, som er et mål for styrken af den molekylære polaritet.
2. Elektronegativitetsforskel :Et molekyles polaritet bestemmes af forskellen i elektronegativitet mellem de atomer, der udgør molekylet. Elektronegativitet er et mål for et atoms evne til at tiltrække elektroner. Når elektronegativitetsforskellen mellem to atomer er stor, vil molekylet være mere polært.
3. Båndpolaritet :Bindingerne mellem atomer i et polært molekyle er polære kovalente bindinger. Polære kovalente bindinger opstår, når elektronerne i bindingen deles ulige mellem atomerne. Denne ulige deling af elektroner skaber en delvis positiv ladning på det ene atom og en delvis negativ ladning på det andet atom.
4. Molekylær geometri :Et polært molekyls molekylære geometri påvirker også dets polaritet. Molekyler med en symmetrisk molekylær geometri, såsom kuldioxid (CO2), har ingen nettopolaritet. Imidlertid har molekyler med en asymmetrisk molekylær geometri, såsom vand (H2O), en nettopolaritet.
5. Dipolmoment :Dipolmomentet for et polært molekyle er et mål for styrken af dets polaritet. Dipolmomentet er en vektormængde, der peger fra den positive ende af molekylet til den negative ende. Størrelsen af dipolmomentet er lig med produktet af ladningsadskillelsen og afstanden mellem de positive og negative ender af molekylet.
Sidste artikelHvad er molekylerne i pap?
Næste artikelHvad er kogepunktet smeltepunkt og normal fase af Xenon?
 Varme artikler
Varme artikler
-
 Overvågning af kroppens fedtforbrænding ved at prøve åndedrættetMåleopsætningen. Kredit:Tohoku University Dit åndedræt har nøglen til at overvåge fedtforbrænding, og nu har en forskergruppe fra Tohoku University skabt en kompakt og billig enhed, der kan måle,
Overvågning af kroppens fedtforbrænding ved at prøve åndedrættetMåleopsætningen. Kredit:Tohoku University Dit åndedræt har nøglen til at overvåge fedtforbrænding, og nu har en forskergruppe fra Tohoku University skabt en kompakt og billig enhed, der kan måle, -
 Gennem skueglasset:Optrævler, hvordan ioner bevæger sig i fosfatglasUndersøgelse af den mikroskopiske diffusionsmekanisme af protoner og natriumioner i fosfatglas via første principper molekylær dynamiksimulering indikerer nøglerollen af morfologien af fosfatnetvæ
Gennem skueglasset:Optrævler, hvordan ioner bevæger sig i fosfatglasUndersøgelse af den mikroskopiske diffusionsmekanisme af protoner og natriumioner i fosfatglas via første principper molekylær dynamiksimulering indikerer nøglerollen af morfologien af fosfatnetvæ -
 Forskere rekonstruerer de biokemiske mekanismer ved fotosynteseKredit:CC0 Public Domain Ansvarlig for planternes grønne farve, de væsentlige mekanismer for fremkomsten af fotosyntese er netop blevet undersøgt på niveau med planteceller. Forskere fra univers
Forskere rekonstruerer de biokemiske mekanismer ved fotosynteseKredit:CC0 Public Domain Ansvarlig for planternes grønne farve, de væsentlige mekanismer for fremkomsten af fotosyntese er netop blevet undersøgt på niveau med planteceller. Forskere fra univers -
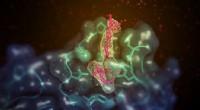 Undersøgelse afslører, hvordan et lille molekyle fremmer fjernelse af overskydende kolesterolEt lille molekyle (vist her i pink) med evnen til at øge godt (HDL) kolesterol i dyremodeller binder sig til det membranbindende domæne af lecithin:kolesterol acyltransferase (LCAT; vist i blågrøn). S
Undersøgelse afslører, hvordan et lille molekyle fremmer fjernelse af overskydende kolesterolEt lille molekyle (vist her i pink) med evnen til at øge godt (HDL) kolesterol i dyremodeller binder sig til det membranbindende domæne af lecithin:kolesterol acyltransferase (LCAT; vist i blågrøn). S
- Børn holder mindre ved, når forældrene tager over
- Sådan identificeres Obsidian
- Sådan beregnes strømstyrketegn
- De ældste homininer i Olduvai Gorge fortsatte på tværs af skiftende miljøer
- I varmt vand? Undersøgelse siger, at opvarmning kan reducere livet i havet med 17 %
- Forskeren søger at øge optagelsen på college, succes blandt plejede unge


