Hvorfor har 1 butanol et højere kogepunkt end diethylether?
Her er en tabel, der opsummerer kogepunkterne for 1-butanol og diethylether:
| Sammensatte | Kogepunkt (°C) |
|---|---|
| 1-butanol | 117,7 |
| Diethylether | 34,5 |
Som du kan se, har 1-butanol et meget højere kogepunkt end diethylether. Denne forskel i kogepunkter skyldes forskellen i intermolekylære kræfter mellem de to forbindelser.
Sidste artikelHvorfor er syrer og baser farlige?
Næste artikelHvad er to anvendelser for vand, der er blevet opvarmet af varm sten?
 Varme artikler
Varme artikler
-
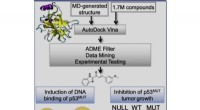 Ny undersøgelse afslører en beregningsstyret tilgang til at undertrykke kræfttumorvækstGrafisk abstrakt. Kredit:Geetha Durairaj et al., Cell Chemical Biology (2022). DOI:10.1016/j.chembiol.2022.07.003 En ny undersøgelse, ledet af forskere fra University of California, Irvine og Unive
Ny undersøgelse afslører en beregningsstyret tilgang til at undertrykke kræfttumorvækstGrafisk abstrakt. Kredit:Geetha Durairaj et al., Cell Chemical Biology (2022). DOI:10.1016/j.chembiol.2022.07.003 En ny undersøgelse, ledet af forskere fra University of California, Irvine og Unive -
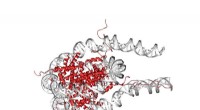 Bøjning af DNA koster mindre energi end antagetKredit:Leiden Institut for Fysik Måden DNA folder i høj grad bestemmer, hvilke gener der udlæses. John van Noort og hans gruppe har kvantificeret, hvor let sammenrullede DNA-dele stables. Dette ko
Bøjning af DNA koster mindre energi end antagetKredit:Leiden Institut for Fysik Måden DNA folder i høj grad bestemmer, hvilke gener der udlæses. John van Noort og hans gruppe har kvantificeret, hvor let sammenrullede DNA-dele stables. Dette ko -
 Metalinnovation tilbyder en unik, omkostningseffektiv mulighed for VVS- og fremstillingsindustrierEn ny innovation af kobber-manganlegering fra Purdue University tilbyder en unik mulighed for VVS- og fremstillingsindustrien. Kredit:Purdue University En opdagelse foretaget af forskere for at si
Metalinnovation tilbyder en unik, omkostningseffektiv mulighed for VVS- og fremstillingsindustrierEn ny innovation af kobber-manganlegering fra Purdue University tilbyder en unik mulighed for VVS- og fremstillingsindustrien. Kredit:Purdue University En opdagelse foretaget af forskere for at si -
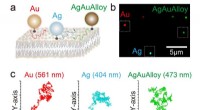 Hurtig og præcis flerfarvebilleddannelse af biomolekyler nu muligBrugen af guld, sølv og guld-sølv legering nanopartikler tillod højhastigheds/høj præcision flerfarve billeddannelse for første gang. Kredit:Ryota Iino, Institut for Molekylær Videnskab, National In
Hurtig og præcis flerfarvebilleddannelse af biomolekyler nu muligBrugen af guld, sølv og guld-sølv legering nanopartikler tillod højhastigheds/høj præcision flerfarve billeddannelse for første gang. Kredit:Ryota Iino, Institut for Molekylær Videnskab, National In
- Glade arbejdere er 13 % mere produktive
- Et fosfolipidmolekyle har en polær og ikke-polær ende på grund af dette, hvilken slags binding da…
- Mennesker og dyreliv trues nu af hurtig ødelæggelse af skove i det centrale Amerika
- Er super-Jorden faktisk mini-Neptunes?
- Model simulerer global vandforsyning
- Hvorfor er kobberhydroxid en svag base?


