Hvorfor frigiver elektrolyse af koncentreret vandigt natriumchlorid klor i stedet for oxygen ved anoden?
1. Chloridionkoncentration :Koncentrationen af chloridioner (Cl-) i en koncentreret NaCl-opløsning er væsentligt højere sammenlignet med andre ioner, såsom hydroxidioner (OH-) eller vandmolekyler (H2O). Som et resultat er der større sandsynlighed for, at chloridioner oxideres og danner klorgas ved anoden.
2. Oxidationspotentiale :Oxidationspotentialet for chloridioner (Cl- til Cl2) er lavere end for hydroxidioner (OH- til O2) og vandmolekyler (H2O til O2). Det betyder, at det kræver mindre energi at oxidere chloridioner og producere klorgas.
Standard oxidationspotentialerne ved 25°C er:
- Cl- → Cl2 (g) + 2 e- E° =1,36 V
- 2 H2O (l) → O2 (g) + 4 H+ (aq) + 4 e- E° =1,23 V
Derfor oxideres chloridioner under de samme betingelser fortrinsvis, hvilket fører til dannelsen af klorgas ved anoden.
3. Konkurrerende reaktioner :Ved elektrolyse af vand er iltudvikling fra vandmolekyler (2H2O → O2 + 4H+ + 4e-) en konkurrerende reaktion på oxidationen af chloridioner. Tilstedeværelsen af koncentrerede chloridioner flytter dog ligevægten mod chlorudvikling på grund af den højere koncentration af chloridioner og deres lavere oxidationspotentiale.
Sammenfattende resulterer kombinationen af en høj koncentration af chloridioner, et lavere oxidationspotentiale for chloridoxidation og tilstedeværelsen af konkurrerende reaktioner fra vandmolekyler i frigivelsen af klorgas i stedet for oxygen ved anoden under elektrolysen af koncentreret vandigt natrium chloridopløsning.
Sidste artikelHvad er hybridiseringen af c2h2?
Næste artikelEt grundstofs atomnummer er lig med af?
 Varme artikler
Varme artikler
-
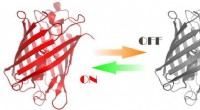 Forskere skabte proteiner styret af lys3D-model af det udviklede protein Kredit:Aleksandr Mishin Forskere har udviklet fluorescerende proteiner, der kan styres af orange og grønt lys. Disse proteiner vil hjælpe med at studere processer
Forskere skabte proteiner styret af lys3D-model af det udviklede protein Kredit:Aleksandr Mishin Forskere har udviklet fluorescerende proteiner, der kan styres af orange og grønt lys. Disse proteiner vil hjælpe med at studere processer -
 Video:Hvordan virker udløbsdatoer for lægemidlerKredit:The American Chemical Society Vi har alle set udløbsdatoerne på receptpligtig og håndkøbsmedicin. Hvad der er mindre indlysende for os som forbrugere, er, hvordan disse datoer bestemmes, o
Video:Hvordan virker udløbsdatoer for lægemidlerKredit:The American Chemical Society Vi har alle set udløbsdatoerne på receptpligtig og håndkøbsmedicin. Hvad der er mindre indlysende for os som forbrugere, er, hvordan disse datoer bestemmes, o -
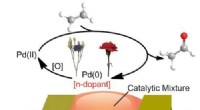 Ethylensensor kan hjælpe med at overvåge plantesundhedKredit:American Chemical Society For at kontrollere blomstring og frugtmodning, planter frigiver det gasformige hormon ethylen. Miljøbetingelser, herunder tørke, saltindhold og patogener, kan også
Ethylensensor kan hjælpe med at overvåge plantesundhedKredit:American Chemical Society For at kontrollere blomstring og frugtmodning, planter frigiver det gasformige hormon ethylen. Miljøbetingelser, herunder tørke, saltindhold og patogener, kan også -
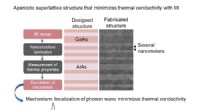 Minimering af termisk ledningsevne af krystallinsk materiale med optimal nanostrukturDen optimale nanostruktur designet med MI (aperiodisk supergitterstruktur) blev faktisk fremstillet, og den optimale ydeevne blev verificeret ved at vurdere dens varmeledningsevne. Figur:Den faktiske
Minimering af termisk ledningsevne af krystallinsk materiale med optimal nanostrukturDen optimale nanostruktur designet med MI (aperiodisk supergitterstruktur) blev faktisk fremstillet, og den optimale ydeevne blev verificeret ved at vurdere dens varmeledningsevne. Figur:Den faktiske
- Redder energibesparelse klimaet?
- Ros, frem for at straffe, at se op til 30 % større fokus i klasseværelset
- Hvad kan ændringer i termisk energi måles med?
- Forskere mener, at undersøgelser foretaget af kolleger er mere tilbøjelige til skævheder end dere…
- Små partikler, som frøskyer kan danne af sporgasser over åbent hav
- Nye digitale medier holder familier forbundet gennem tvungen migration


