Hvad sker der med hastighedskonstanten for en kemisk reaktion, når temperaturen stiger?
Forholdet mellem hastighedskonstanten (k) og temperatur (T) er ofte beskrevet af Arrhenius-ligningen:
k =Ae^(-Ea/RT)
Hvor:
- A er den præ-eksponentielle faktor eller frekvensfaktor, som repræsenterer hyppigheden af kollisioner mellem reaktantmolekyler med den korrekte orientering og tilstrækkelig energi.
- Ea er reaktionens aktiveringsenergi, som er den mindste energi, der kræves for, at reaktanterne kan nå overgangstilstanden.
- R er gaskonstanten (8,314 J/mol*K)
-T er den absolutte temperatur i Kelvin
Ifølge Arrhenius-ligningen falder det eksponentielle led e^(-Ea/RT), når temperaturen (T) stiger, hvilket fører til en samlet stigning i hastighedskonstanten (k). Derfor resulterer højere temperaturer generelt i hurtigere reaktionshastigheder på grund af hyppigere vellykkede kollisioner og en højere andel af reaktantmolekyler, der besidder den nødvendige aktiveringsenergi.
Sidste artikelHvilken generel ligning viser en enkeltforskydningsreaktion?
Næste artikelHvordan kan varmes effekt på en reaktion bestemmes?
 Varme artikler
Varme artikler
-
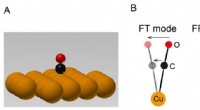 Belysning af vibrationsenergi af et enkelt molekyle i et eksternt kraftfeltFigur 1A:Skematisk billede af et enkelt CO-molekyle i ensomhed adsorberet på en enkelt kobberkrystal. 1B:Skematiske billeder af vibrationer af et CO-molekyle adsorberet på en kobberoverflade. Et CO-mo
Belysning af vibrationsenergi af et enkelt molekyle i et eksternt kraftfeltFigur 1A:Skematisk billede af et enkelt CO-molekyle i ensomhed adsorberet på en enkelt kobberkrystal. 1B:Skematiske billeder af vibrationer af et CO-molekyle adsorberet på en kobberoverflade. Et CO-mo -
 Hvordan en bestemt bakterie kommunikerer og gør os sygeKredit:CC0 Public Domain Forskere ved Binghamton University, State University of New York har afdækket den unikke måde, hvorpå en type gramnegativ bakterie leverer de toksiner, der gør os syge. At
Hvordan en bestemt bakterie kommunikerer og gør os sygeKredit:CC0 Public Domain Forskere ved Binghamton University, State University of New York har afdækket den unikke måde, hvorpå en type gramnegativ bakterie leverer de toksiner, der gør os syge. At -
 Laboratoriegennembrud inden for 3-D print af glasEn ny 3D-printteknik, udviklet hos Lawrence Livermore, kunne tillade videnskabsmænd at udskrive glas, der inkorporerer forskellige brydningsindekser i en enkelt flad optik, gør efterbehandling billige
Laboratoriegennembrud inden for 3-D print af glasEn ny 3D-printteknik, udviklet hos Lawrence Livermore, kunne tillade videnskabsmænd at udskrive glas, der inkorporerer forskellige brydningsindekser i en enkelt flad optik, gør efterbehandling billige -
 Forskere finder intermolekylære kræfter stabiliserer klynger, fremme aerosolproduktionKredit:CC0 Public Domain En gåde, der har forvirret videnskabsmænd, er, hvordan nye partikler dannes i atmosfæren. De ved, hvordan aerosoler kan vokse til størrelser, der er store nok til at udså
Forskere finder intermolekylære kræfter stabiliserer klynger, fremme aerosolproduktionKredit:CC0 Public Domain En gåde, der har forvirret videnskabsmænd, er, hvordan nye partikler dannes i atmosfæren. De ved, hvordan aerosoler kan vokse til størrelser, der er store nok til at udså
- Hvor mange atomer af LiBr ville du have, hvis du starter med 1,25 mol. Hvad er svaret, og hvordan fi…
- Udvidelse af tunkvoter træder tilbage for bevarelse
- Undersøgelse afslører virkningen af magtfulde administrerende direktører og hvidvaskning af pen…
- En galaktisk perle:FORS2-instrument fanger fantastiske detaljer om spiralgalaksen NGC 3981
- Gennemsigtige batterier:ser du direkte ind i fremtiden? (med video)
- Coronavirus kan være Generation Zs 9/11


