Er CH3CO2- en syre eller base?
CH3CO2- + H2O ⇌ CH3COOH + OH-
Ligevægtskonstanten for denne reaktion kaldes eddikesyrens syredissociationskonstanten (Ka). Jo mindre Ka-værdien er, jo stærkere er syren. Ka-værdien for eddikesyre er 1,8 × 10^-5, hvilket betyder, at eddikesyre er en svag syre.
Da acetationen er den konjugerede base af en svag syre, er den en svag base. Det betyder, at acetationen kan acceptere en proton fra vand for at danne eddikesyre- og hydroxidioner. Reaktionen kan repræsenteres som følger:
CH3CO2- + H2O ⇌ CH3COOH + OH-
Ligevægtskonstanten for denne reaktion kaldes basedissociationskonstanten (Kb) for acetationen. Kb-værdien for acetationen er 5,6 × 10^-10, hvilket betyder, at acetationen er en svag base.
Sammenfattende er acetationen en svag base, fordi den kan acceptere en proton fra vand for at danne eddikesyre- og hydroxidioner.
Sidste artikelBalance af C9H20 plus O2 er lig med CO2?
Næste artikelVidenskabelig anvendelse af det periodiske system?
 Varme artikler
Varme artikler
-
 Kemikeres gennembrud i syntese fremmer et potent anti-kræftmiddelVi brugte årtier på grundforskning og gjorde meget dramatiske fremskridt, sagde Yoshito Kishi, Morris Loeb, professor i kemi, Emeritus, i Harvards afdeling for kemi og kemisk biologi. Kredit:Stephanie
Kemikeres gennembrud i syntese fremmer et potent anti-kræftmiddelVi brugte årtier på grundforskning og gjorde meget dramatiske fremskridt, sagde Yoshito Kishi, Morris Loeb, professor i kemi, Emeritus, i Harvards afdeling for kemi og kemisk biologi. Kredit:Stephanie -
 Hvordan opbygger bakterier naturlige produkter?Et kompleks af tre proteiner beskytter det meget reaktive hexaketid, når det forlænges til octaketidet. I samarbejde med andre proteiner, vigtige naturlige stoffer produceres fra det resulterende octa
Hvordan opbygger bakterier naturlige produkter?Et kompleks af tre proteiner beskytter det meget reaktive hexaketid, når det forlænges til octaketidet. I samarbejde med andre proteiner, vigtige naturlige stoffer produceres fra det resulterende octa -
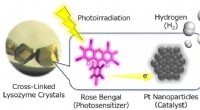 Forskere bruger æggehvider til ren energiproduktionHydrogen (H2) udviklingssystemer konstrueret i tværbundne porøse lysozymkrystaller ved at immobilisere Pt-nanopartikler som H2-evolutionskatalysatorer i umiddelbar nærhed af en organisk fotosensibilis
Forskere bruger æggehvider til ren energiproduktionHydrogen (H2) udviklingssystemer konstrueret i tværbundne porøse lysozymkrystaller ved at immobilisere Pt-nanopartikler som H2-evolutionskatalysatorer i umiddelbar nærhed af en organisk fotosensibilis -
 Supercomputere simulerer nye veje til potentiel behandling af RNA-virusStrukturelle ændringer i RNA under lægemiddelbinding/afbinding. Kredit:Lev Levintov, University of New Hampshire University of New Hampshire (UNH) forskere brugte for nylig Comet ved San Diego Sup
Supercomputere simulerer nye veje til potentiel behandling af RNA-virusStrukturelle ændringer i RNA under lægemiddelbinding/afbinding. Kredit:Lev Levintov, University of New Hampshire University of New Hampshire (UNH) forskere brugte for nylig Comet ved San Diego Sup
- Forurening i det asiatiske tropopauselag kommer fra menneskelige aktiviteter og naturlige kilder, un…
- Værdsat, penge og mysterium:Fem ting at vide om Nobels
- Jordens vejrtrækning:bjergerosion en manglende brik i klimapuslespillet
- Catalina-hjort i trådkorset:Vil kompromis afværge en planlagt slagtning?
- Elcykler og lydløse lastbiler til levering af grønne varer
- Multigenerationel bolig:En strategi til at klare uoverkommelige boliger?


