Hvordan er smeltepunktet sammenlignet mellem molekylære forbindelser og ioniske forbindelser?
Molekylære forbindelser:
- Molekylære forbindelser er sammensat af molekyler, der holdes sammen af intermolekylære kræfter, såsom van der Waals-kræfter, dipol-dipol-interaktioner eller hydrogenbinding.
- Intermolekylære kræfter er generelt svagere end ionbindingerne i ionforbindelser.
- Svagere kræfter kræver mindre energi at overvinde, hvilket resulterer i lavere smeltepunkter for molekylære forbindelser.
Ioniske forbindelser:
- Ioniske forbindelser består af positivt ladede ioner (kationer) og negativt ladede ioner (anioner) holdt sammen af stærke elektrostatiske kræfter kaldet ionbindinger.
- Ionbindinger er betydeligt stærkere end intermolekylære kræfter.
- De stærke tiltrækningskræfter mellem modsat ladede ioner i ionforbindelser kræver mere energi for at bryde, hvilket fører til højere smeltepunkter.
Som en generel tendens har molekylære forbindelser en tendens til at have smeltepunkter, der spænder fra lave til moderate temperaturer, mens ioniske forbindelser typisk udviser højere smeltepunkter. Her er nogle eksempler:
Molekylære forbindelser:
- Methan (CH4):-182,5°C
- Ethanol (CH3CH2OH):-114,1°C
- Saccharose (C12H22O11):186°C
Ioniske forbindelser:
- Natriumchlorid (NaCl):801°C
- Calciumoxid (CaO):2.613°C
- Jern(III)oxid (Fe2O3):1.566°C
Konceptet med smeltepunktssammenligning mellem molekylære og ioniske forbindelser gælder også for andre forbindelseskategorier, såsom kovalente netværksfaststoffer og metalliske forbindelser. Kovalente netværksfaststoffer, såsom diamant, har ekstremt stærke kovalente bindinger og usædvanligt høje smeltepunkter. Metalliske forbindelser, karakteriseret ved metallisk binding, har generelt mellemliggende smeltepunkter sammenlignet med molekylære og ioniske forbindelser.
 Varme artikler
Varme artikler
-
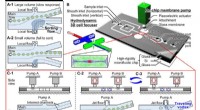 Banebrydende oprensning af fossilt pollen ved hjælp af en ny storpartikel-on-chip sortererKonceptuelle billeder af det foreslåede on-chip sorteringssystem for store partikler baseret på spatiotemporalt genererede rejsehvirvler. (A) Konceptuelle billeder af konventionel partikelsortering på
Banebrydende oprensning af fossilt pollen ved hjælp af en ny storpartikel-on-chip sortererKonceptuelle billeder af det foreslåede on-chip sorteringssystem for store partikler baseret på spatiotemporalt genererede rejsehvirvler. (A) Konceptuelle billeder af konventionel partikelsortering på -
 Peptidpapirer peger på nye måder at tackle bakterier påLektor Max Cryle og medlemmer af hans laboratorium. Kredit:Monash University Et team af forskere har løst en 20-årig gåde om, hvordan et afgørende skridt i biosyntesen af sidste udvej antibiotik
Peptidpapirer peger på nye måder at tackle bakterier påLektor Max Cryle og medlemmer af hans laboratorium. Kredit:Monash University Et team af forskere har løst en 20-årig gåde om, hvordan et afgørende skridt i biosyntesen af sidste udvej antibiotik -
 Forskere sporer proteinbinding, bygger syntetiske proteiner for at studere genekspressionKredit:Unsplash/CC0 Public Domain Hvordan husker en næse, at det er en næse? Eller husker et øje, at det er et øje? Mens forskere undersøger spørgsmålet om, hvordan celler husker, hvilken slags ce
Forskere sporer proteinbinding, bygger syntetiske proteiner for at studere genekspressionKredit:Unsplash/CC0 Public Domain Hvordan husker en næse, at det er en næse? Eller husker et øje, at det er et øje? Mens forskere undersøger spørgsmålet om, hvordan celler husker, hvilken slags ce -
 Måling af små kræfter, der fører til store effekterTop:Modificeret cantilever med en boehmit-krystal monteret på en siliciumstolpe, som er monteret på AFM udkrageren. Nederst:Interaktioner mellem den modificerede cantilever og et boehmit-substrat kvan
Måling af små kræfter, der fører til store effekterTop:Modificeret cantilever med en boehmit-krystal monteret på en siliciumstolpe, som er monteret på AFM udkrageren. Nederst:Interaktioner mellem den modificerede cantilever og et boehmit-substrat kvan
- Afvejninger mellem økonomisk vækst og skovrydning
- Forskere kaster livline til verdens sjældneste primat
- Hvor tæt er en celle? Forskere har udtænkt en måde at besvare dette spørgsmål på
- Hvordan bryder vaskemiddel overfladespænding?
- Kvasarstråler er partikelacceleratorer tusindvis af lysår lange
- Ekspertblog:Sådan håndterer du falske nyheder og misinformation


