Hvor mange elektroner modtager et ikke-metal og metal under kemisk reaktion?
Her er de generelle tendenser:
Metaller: Metaller har en tendens til at miste elektroner under kemiske reaktioner og bliver positivt ladede ioner kaldet kationer. Dette skyldes, at metaller har relativt lav elektronegativitet, hvilket betyder, at de har en svagere tiltrækning af elektroner. Ved at miste elektroner opnår metaller en mere stabil elektronkonfiguration med et fuldt ydre energiniveau.
Ikke-metaller: Ikke-metaller har på den anden side en tendens til at få elektroner under kemiske reaktioner og bliver negativt ladede ioner kaldet anioner. Dette skyldes, at ikke-metaller har relativt høj elektronegativitet, hvilket betyder, at de har en stærkere tiltrækning af elektroner. Ved at få elektroner opnår ikke-metaller en mere stabil elektronkonfiguration med et fuldt ydre energiniveau.
Det specifikke antal elektroner, som et atom vinder eller taber i en kemisk reaktion, bestemmes af dets placering i det periodiske system. Grundstoffer i samme gruppe (lodret søjle) har en tendens til at have det samme antal valenselektroner, som er elektronerne i det yderste energiniveau, og derfor har de en tendens til at gennemgå lignende kemiske reaktioner.
For eksempel mister alkalimetaller i gruppe 1 altid en elektron, jordalkalimetaller i gruppe 2 mister altid to elektroner, og halogener i gruppe 7 får altid en elektron.
Generelt er antallet af elektroner opnået eller tabt i en kemisk reaktion bestemt af elektronegativitetsforskellen mellem de involverede atomer. Jo større elektronegativitetsforskellen er, jo mere sandsynligt er det, at reaktionen vil resultere i dannelsen af ioner.
Sidste artikelEr vand en alkali i kemi?
Næste artikelElcetroner brugt til at danne kemiske bindinger?
 Varme artikler
Varme artikler
-
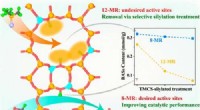 Ny strategi til at kontrollere fordelingen af syresteder i zeolitterGrafisk abstrakt. Kredit:ACS Catalysis (2022). DOI:10.1021/acscatal.1c05896 Zeolitter er en af de formselektive katalysatorer. Zeolitternes egenskaber, som kommer fra den strukturelle indeslutnin
Ny strategi til at kontrollere fordelingen af syresteder i zeolitterGrafisk abstrakt. Kredit:ACS Catalysis (2022). DOI:10.1021/acscatal.1c05896 Zeolitter er en af de formselektive katalysatorer. Zeolitternes egenskaber, som kommer fra den strukturelle indeslutnin -
 Genanvendelse af sjældne jordarters magneter er en kværn, men ny proces tager en enklere tilgangPlasma lommelygte afsætter genbrugsmagnetmateriale. Kredit:Ames Laboratory En ny genbrugsproces udviklet ved det amerikanske energiministeriums Critical Materials Institute (CMI) forvandler kasser
Genanvendelse af sjældne jordarters magneter er en kværn, men ny proces tager en enklere tilgangPlasma lommelygte afsætter genbrugsmagnetmateriale. Kredit:Ames Laboratory En ny genbrugsproces udviklet ved det amerikanske energiministeriums Critical Materials Institute (CMI) forvandler kasser -
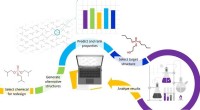 Sådan designes sikre og bæredygtige kemikalierMetode præsenteret af forskerne. Som et casestudie genererede de over seks millioner alternativer til en populær flammehæmmer og evaluerede deres egenskaber. Kredit:UvA/HIMS Med mange menneskeskabt
Sådan designes sikre og bæredygtige kemikalierMetode præsenteret af forskerne. Som et casestudie genererede de over seks millioner alternativer til en populær flammehæmmer og evaluerede deres egenskaber. Kredit:UvA/HIMS Med mange menneskeskabt -
 Forskere gør vitamin B12 gennembrudProfessor Martin Warren med elever fra Sir Roger Manwood School. Kredit:University of Kent Forskere ved University of Kent har gjort en betydelig opdagelse om, hvordan vitaminindholdet i nogle pla
Forskere gør vitamin B12 gennembrudProfessor Martin Warren med elever fra Sir Roger Manwood School. Kredit:University of Kent Forskere ved University of Kent har gjort en betydelig opdagelse om, hvordan vitaminindholdet i nogle pla


