Hvad er den kovalente binding af CO2?
Lewis-strukturen af kuldioxid viser, at kulstofatomet er omgivet af fire elektroner, to fra hvert oxygenatom. Dette opfylder oktetreglen for kulstof, som siger, at kulstofatomer har en tendens til at have otte elektroner i deres ydre skal. De to oxygenatomer har hver seks elektroner i deres ydre skal, hvilket også opfylder oktetreglen.
Dobbeltbindingerne mellem kulstof- og oxygenatomerne i kuldioxid er stærke og stabile, hvilket gør det til et relativt inert molekyle. Det er grunden til, at kuldioxidgas almindeligvis bruges som ildslukker, da den kan fortrænge ilt og forhindre forbrænding. Kuldioxid bruges også til fremstilling af kulsyreholdige drikkevarer, da det opløses i vand til dannelse af kulsyre, hvilket giver disse drikkevarer deres skarpe smag.
Sidste artikelHvilke andre ioner tiltrækkes evey i en ionforbindelse?
Næste artikelIfølge teorien ville et ophidset atom?
 Varme artikler
Varme artikler
-
 Aerogel:Fremtidens mikrostrukturmaterialeFor at demonstrere, at fine aerogelstrukturer kan fremstilles i 3D-print, forskerne trykte en lotusblomst lavet af aerogel. Kredit:Empa Aerogel er en fremragende termisk isolator. Indtil nu, imidl
Aerogel:Fremtidens mikrostrukturmaterialeFor at demonstrere, at fine aerogelstrukturer kan fremstilles i 3D-print, forskerne trykte en lotusblomst lavet af aerogel. Kredit:Empa Aerogel er en fremragende termisk isolator. Indtil nu, imidl -
 Banebrydende ny genanvendelig klæbemiddel virker under vandetIllinois-forskere undersøgelse af formhukommelsespolymerer (SMPer) er omtalt i den seneste udgave af Advance Materials Interface . Kredit: Advance Materials Interface Illinois-forskere har intr
Banebrydende ny genanvendelig klæbemiddel virker under vandetIllinois-forskere undersøgelse af formhukommelsespolymerer (SMPer) er omtalt i den seneste udgave af Advance Materials Interface . Kredit: Advance Materials Interface Illinois-forskere har intr -
 sekvensering, mRNA, eller måske nanokrystaller? Vidt åbent felt til Nobels KemiprisKemi Nobel er den tredje, der bliver uddelt i denne uge, efter medicin og fysik. Gennembrud i DNA-sekventering, innovativ gaslagring, nanokrystaller eller en ny chance for mRNA Covid-19-vacciner?
sekvensering, mRNA, eller måske nanokrystaller? Vidt åbent felt til Nobels KemiprisKemi Nobel er den tredje, der bliver uddelt i denne uge, efter medicin og fysik. Gennembrud i DNA-sekventering, innovativ gaslagring, nanokrystaller eller en ny chance for mRNA Covid-19-vacciner? -
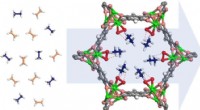 Nyt materiale kunne gøre plastikfremstilling mere energieffektivDenne jernbaserede metal-organiske ramme dekoreret med peroxo-grupper (røde og grønne) kan fange ethan (blå molekyler), mens den tillader ethylen (ferskenmolekyler) at passere igennem, potentielt give
Nyt materiale kunne gøre plastikfremstilling mere energieffektivDenne jernbaserede metal-organiske ramme dekoreret med peroxo-grupper (røde og grønne) kan fange ethan (blå molekyler), mens den tillader ethylen (ferskenmolekyler) at passere igennem, potentielt give


