Hvis 1,25 gram ren CaCO3 krævede 25,5 mL en HCl-opløsning for fuldstændig restitution, hvad er molaritetsopløsningen?
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O(l) + CO2(g)
Ud fra ligningen kan vi se, at 1 mol CaCO3 reagerer med 2 mol HCl. Den molære masse af CaCO3 er 100,09 g/mol, så 1,25 gram CaCO3 er lig med 1,25 / 100,09 =0,0125 mol CaCO3.
Da 0,0125 mol CaCO3 reagerer med 25,5 ml HCl-opløsning, kan molariteten af HCl-opløsningen beregnes som følger:
Molaritet =mol opløst stof / volumen opløsning i liter
Molaritet =0,0125 mol / (25,5 ml / 1000) L
Molaritet =0,0125 mol / 0,0255 L
Molaritet =0,489 M
Derfor er molariteten af HCl-opløsningen 0,489 M.
 Varme artikler
Varme artikler
-
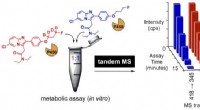 Ny screeningsmetode udviklet til at bekræfte, om deuteration forbedrer metabolisk stabilitetBilledtekst:(Venstre) Metabolsk assay i en gryde af en 1:1 blanding af deutereret og ikke-deutereret molekyle. (Højre) overvågningssignaler ved tandem MS for begge analoger (blå og røde søjler). En af
Ny screeningsmetode udviklet til at bekræfte, om deuteration forbedrer metabolisk stabilitetBilledtekst:(Venstre) Metabolsk assay i en gryde af en 1:1 blanding af deutereret og ikke-deutereret molekyle. (Højre) overvågningssignaler ved tandem MS for begge analoger (blå og røde søjler). En af -
 Forsker bruger raps til at skabe bionedbrydeligt cling wrapU of A-forsker Marleny Saldaña i sit laboratorium med en prøve af malet rapshalm. Saldaña brugte affaldsbiproduktet til at skabe cellulosefibre, der gør det biologisk nedbrydeligt, plantebaseret cling
Forsker bruger raps til at skabe bionedbrydeligt cling wrapU of A-forsker Marleny Saldaña i sit laboratorium med en prøve af malet rapshalm. Saldaña brugte affaldsbiproduktet til at skabe cellulosefibre, der gør det biologisk nedbrydeligt, plantebaseret cling -
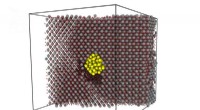 Forskere finder forklaring på unormalt hurtig frigivelse af gas fra atombrændstofEksempel på en beregningscelle:et krystalgitter af urandioxid (grå atomer er uran, røde atomer - ilt) indeholdende en boble af xenon (gule atomer). Uranatomer forskudt til inter-nodale positioner er v
Forskere finder forklaring på unormalt hurtig frigivelse af gas fra atombrændstofEksempel på en beregningscelle:et krystalgitter af urandioxid (grå atomer er uran, røde atomer - ilt) indeholdende en boble af xenon (gule atomer). Uranatomer forskudt til inter-nodale positioner er v -
 Konstrueret E. coli kunne lave kulhydrater, vedvarende brændstof, fra CO2Kredit:Pixabay/CC0 Public Domain Forskere fra Newcastle University, UK har konstrueret Escherichia coli bakterier til at opfange kuldioxid (CO 2 ) ved hjælp af brintgas (H 2 ) for at omdanne
Konstrueret E. coli kunne lave kulhydrater, vedvarende brændstof, fra CO2Kredit:Pixabay/CC0 Public Domain Forskere fra Newcastle University, UK har konstrueret Escherichia coli bakterier til at opfange kuldioxid (CO 2 ) ved hjælp af brintgas (H 2 ) for at omdanne


