Leder kovalente forbindelser elektricitet som flydende eller fast stof?
Der er dog nogle få undtagelser fra denne regel. For eksempel kan nogle kovalente forbindelser, såsom grafit, lede elektricitet i fast tilstand på grund af tilstedeværelsen af delokaliserede elektroner. I grafit er kulstofatomerne arrangeret i en sekskantet gitterstruktur, og elektronerne i kulstofatomernes ydre skal kan bevæge sig frit gennem hele gitteret. Dette gør det muligt for grafit at lede elektricitet på samme måde som metaller.
Derudover kan nogle kovalente forbindelser lede elektricitet i flydende tilstand, hvis de er opløst i et polært opløsningsmiddel. Et polært opløsningsmiddel er et opløsningsmiddel, der har en delvis positiv ladning i den ene ende af molekylet og en delvis negativ ladning i den anden ende. Når en kovalent forbindelse opløses i et polært opløsningsmiddel, kan opløsningsmiddelmolekylerne interagere med den kovalente forbindelse og få elektronerne til at blive delokaliseret. Dette kan tillade forbindelsen at lede elektricitet i opløsning.
 Varme artikler
Varme artikler
-
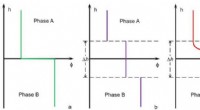 Forskere afslører naturen af jordvand og dets faseovergangFig. 1. De abstrakte grænseflademodeller mellem fase A og fase B. a:den skarpe Gibbs-grænseflademodel; b:den ensartede grænseflademodel; c:modellen med diffuse grænseflader. h er grænsefladetykkelsen.
Forskere afslører naturen af jordvand og dets faseovergangFig. 1. De abstrakte grænseflademodeller mellem fase A og fase B. a:den skarpe Gibbs-grænseflademodel; b:den ensartede grænseflademodel; c:modellen med diffuse grænseflader. h er grænsefladetykkelsen. -
 Kemikere bygger naturlig anti-cancer forbindelse med en effektiv ny procesKredit:CC0 Public Domain Scripps Research kemikere Hans Renata, Ph.D., og Alexander Adibekian, Ph.D., har opdaget en måde til effektivt at skabe en syntetisk version af en værdifuld naturlig forbi
Kemikere bygger naturlig anti-cancer forbindelse med en effektiv ny procesKredit:CC0 Public Domain Scripps Research kemikere Hans Renata, Ph.D., og Alexander Adibekian, Ph.D., har opdaget en måde til effektivt at skabe en syntetisk version af en værdifuld naturlig forbi -
 Kuldioxidmineralisering i geologisk almindelige bjergarter til kulstoflagringDen røde farve angiver, at sandsynligheden for forekomst af valenselektroner er 100 procent, den blå farve betyder, at der ikke findes elektroner i området, og den grønne farve betyder fri elektrongas
Kuldioxidmineralisering i geologisk almindelige bjergarter til kulstoflagringDen røde farve angiver, at sandsynligheden for forekomst af valenselektroner er 100 procent, den blå farve betyder, at der ikke findes elektroner i området, og den grønne farve betyder fri elektrongas -
 Forskere undersøger komplekse molekylære strukturerMolekylerne er blevet analyseret ved forskellige tryk (fra ultrahøjt vakuum til atmosfærisk tryk) Kredit:TU Wien Arbejdet med hæmoglobin ser ud til at være ret simpelt:Det transporterer iltmolekyl
Forskere undersøger komplekse molekylære strukturerMolekylerne er blevet analyseret ved forskellige tryk (fra ultrahøjt vakuum til atmosfærisk tryk) Kredit:TU Wien Arbejdet med hæmoglobin ser ud til at være ret simpelt:Det transporterer iltmolekyl
- Mystisk interstellar besøgende var sandsynligvis et mørkt brint-isbjerg, ikke udlændinge
- Billede:X-ray øje af Athena
- Hvorfor er menneskers hjerner forskellige i størrelse?
- Hvordan adskiller reaktionen af kalium og natrium med koldt vand sig?
- Kunne du identificere en kriminel ved deres stemme? Det er langt sværere, end det lyder
- Farvel til defekt software?


