Hvad bestemmer forholdet mellem ioner i en ionforbindelse?
Forholdet mellem ioner i en ionisk forbindelse kan bestemmes ved at bruge følgende formel:
```
Forholdet mellem kationer og anioner =Ladning af kation / Ladning af anion
```
For eksempel i natriumchlorid er forholdet mellem natriumioner og chloridioner 1:1, fordi ladningen af natriumionen er +1, og ladningen af chloridionen er -1.
Forholdet mellem ioner i en ionforbindelse er også påvirket af størrelsen af ionerne. Mindre ioner kan pakke mere tæt sammen end større ioner, så en forbindelse med mindre ioner vil have et højere forhold mellem kationer og anioner end en forbindelse med større ioner. For eksempel har lithiumfluorid (LiF) et forhold på 1:1, mens kaliumiodid (KI) har et forhold på 1:2. Dette skyldes, at lithium-ionen er mindre end kaliumionen.
Forholdet mellem ioner i en ionisk forbindelse er en vigtig faktor for at bestemme forbindelsens egenskaber. Forbindelser med et højt forhold mellem kationer og anioner har tendens til at være mere opløselige i vand end forbindelser med et lavt forhold mellem kationer og anioner. Det skyldes, at vandmolekylerne lettere kan opløse ionerne i en forbindelse med et højt forhold mellem kationer og anioner.
 Varme artikler
Varme artikler
-
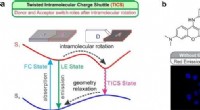 Forskere opdager ny ladningsoverførsel og adskillelsesproces(a) Skematisk illustration af de twisted intramolecular charge shuttle (TICS) mekanismer; D og A betegner elektrondonerende og elektronaccepterende fragmenter, henholdsvis. (b) Reaktionsmekanisme for
Forskere opdager ny ladningsoverførsel og adskillelsesproces(a) Skematisk illustration af de twisted intramolecular charge shuttle (TICS) mekanismer; D og A betegner elektrondonerende og elektronaccepterende fragmenter, henholdsvis. (b) Reaktionsmekanisme for -
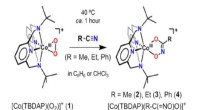 Nyt kompleks, der reagerer med nitril - en nøgle til at muliggøre nedregulering af kræftenzymerSyntetisk procedure for hydroximatocobaltkomplekser gennem reaktioner af et peroxocobaltkompleks 1 med nitriler. Kredit:DGIST Der er forskellige metalenzymer i menneskekroppen. Metalenzymer intera
Nyt kompleks, der reagerer med nitril - en nøgle til at muliggøre nedregulering af kræftenzymerSyntetisk procedure for hydroximatocobaltkomplekser gennem reaktioner af et peroxocobaltkompleks 1 med nitriler. Kredit:DGIST Der er forskellige metalenzymer i menneskekroppen. Metalenzymer intera -
 Forbedring af klæbemidler til bærbare sensorerEn film fremstillet af 4C3-PVA forblev klæbet til to grisehudsoverflader, når de blev adskilt (øverst); en umodificeret PVA-film gjorde det ikke (nederst). Kredit:Tilpasset fra ACS Omega 2020, DOI:1
Forbedring af klæbemidler til bærbare sensorerEn film fremstillet af 4C3-PVA forblev klæbet til to grisehudsoverflader, når de blev adskilt (øverst); en umodificeret PVA-film gjorde det ikke (nederst). Kredit:Tilpasset fra ACS Omega 2020, DOI:1 -
 Hurtig test finder tegn på sepsis i en enkelt dråbe blodUniversity of Illinois forskere og læger på Carle Foundation Hospital udviklede en hurtig test for sepsis, der tæller hvide blodlegemer og proteinmarkører på deres overflade for at overvåge en patient
Hurtig test finder tegn på sepsis i en enkelt dråbe blodUniversity of Illinois forskere og læger på Carle Foundation Hospital udviklede en hurtig test for sepsis, der tæller hvide blodlegemer og proteinmarkører på deres overflade for at overvåge en patient
- 70 højteknologiske kameraer installeret i det sydlige Californien giver øjne på brandudsatte områ…
- Ny undersøgelse udforsker digitalt indfødte, men teknologisk analfabeter studerende
- Første globale kort over stenfald på månen
- Sikkerhedstavle:Søfarere har brug for bedre tropiske stormprognoser
- Beskyttelse af drikkevand på prærier mod en ny forurening
- Hvad bruges et oscilloskop til at måle?


