Hvordan opnår ionisk og kovalent stabilitet?
Kovalent binding :Ved kovalent binding opnår atomer stabilitet ved at dele elektroner. Når atomer deler elektroner, danner de en kovalent binding. Dette delte elektronpar er placeret mellem kernerne i de bundne atomer, hvilket skaber et område med høj elektrontæthed. Tiltrækningen mellem de positivt ladede kerner og de negativt ladede elektroner holder atomerne sammen. For eksempel i det kovalente molekyle metan (CH4) deler hvert carbonatom fire elektroner med fire hydrogenatomer, der danner fire kovalente bindinger. Delingen af elektroner resulterer i et stabilt molekyle.
Her er en tabel, der opsummerer de vigtigste forskelle mellem ionisk og kovalent binding:
| Ejendom | Ionisk binding | Kovalent binding |
|---|---|---|
| Elektronoverførsel | Fuldstændig overførsel af elektroner fra et atom til et andet | Deling af elektroner mellem atomer |
| Obligationstype | Elektrostatisk tiltrækning mellem modsat ladede ioner | Tiltrækning mellem positivt ladede kerner og negativt ladede elektroner delt mellem atomer |
| Dannelse af ioner | Danner ioner (kationer og anioner) | Danner ikke ioner |
| Eksempler | Natriumchlorid (NaCl), kaliumiodid (KI), calciumoxid (CaO) | Metan (CH4), vand (H2O), kuldioxid (CO2) |
Sidste artikelHvilken type egenskaber er lettere at genkende fysisk eller kemisk?
Næste artikelHvad er vigtige ting af kobber?
 Varme artikler
Varme artikler
-
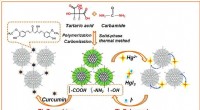 Hvordan nitrogen-doterede fluorescerende kulstofprikker hjælper kampen mod sygdomSkematisk diagram af forberedelses- og responsmekanismen for NCDer. Kredit:Wei Chen Evnen til pålideligt og præcist at detektere niveauer af iodidion og curcumin er afgørende inden for fødevare- o
Hvordan nitrogen-doterede fluorescerende kulstofprikker hjælper kampen mod sygdomSkematisk diagram af forberedelses- og responsmekanismen for NCDer. Kredit:Wei Chen Evnen til pålideligt og præcist at detektere niveauer af iodidion og curcumin er afgørende inden for fødevare- o -
 Turende strukturer i et menneskeskabt interfaceReaktionsdiffusionsprocessen drev dannelsen af den komplicerede uorganiske Turing -struktur. Kredit:ZHANG Xiaolong I 1952, Alan Turing, far til datalogi og kunstig intelligens, foreslået, at vis
Turende strukturer i et menneskeskabt interfaceReaktionsdiffusionsprocessen drev dannelsen af den komplicerede uorganiske Turing -struktur. Kredit:ZHANG Xiaolong I 1952, Alan Turing, far til datalogi og kunstig intelligens, foreslået, at vis -
 Pinde og sten kan knække dine knogler, men denne reaktion redigerer skeletterKredit:CC0 Public Domain Siden Friedrich Wohler syntetiserede urinstof (ved et uheld) tilbage i 1828, kemisk syntese - og organisk syntese for det - har været en drivkraft inden for farmaceutisk i
Pinde og sten kan knække dine knogler, men denne reaktion redigerer skeletterKredit:CC0 Public Domain Siden Friedrich Wohler syntetiserede urinstof (ved et uheld) tilbage i 1828, kemisk syntese - og organisk syntese for det - har været en drivkraft inden for farmaceutisk i -
 Billig vandbehandlingDe nye nikkelkatalysatorer syntetiseret ved Institute of Physical Chemistry PAS muliggør ekstremt effektiv vandbehandling i flowtilstand, der fjerner skadelige organoklorforbindelser. Kredit:IPC PAS,
Billig vandbehandlingDe nye nikkelkatalysatorer syntetiseret ved Institute of Physical Chemistry PAS muliggør ekstremt effektiv vandbehandling i flowtilstand, der fjerner skadelige organoklorforbindelser. Kredit:IPC PAS,
- Dieselinnovation har en ydmyg begyndelse
- Kønsroller former offentlige holdninger til transkønnede militærtjeneste, undersøgelse finder
- Hvis du vander en plante med salt, bevæger du sig ind eller ud af rødderne?
- Forhistorisk bling? Æstetik afgørende faktor i udviklingen af de tidligste kobberlegeringer
- Hvad er de to måder, celler kan få energi på, når der ikke er ilt til stede?
- Oldtidens kvindes DNA giver det første bevis for oprindelsen af en mystisk tabt kultur:Toaleans


