Kan nikkel reagere med saltsyre?
Ni(s) + 2HCl(aq) → NiCl2(aq) + H2(g)
I denne reaktion gennemgår nikkelmetal (Ni) en oxidationsreaktion, hvor det mister to elektroner og danner nikkel(II)-ioner (Ni2+). Hydrogenionerne (H+) i saltsyre reduceres, idet de får elektroner til at danne brintgas (H2).
Reaktiviteten af nikkel med saltsyre afhænger af flere faktorer, herunder koncentrationen af syren, temperatur og overfladearealet af nikkelmetallet. Fortyndet saltsyre ved stuetemperatur kan reagere langsomt med nikkel, hvilket kræver noget tid at observere en signifikant reaktion. Imidlertid kan koncentreret saltsyre og højere temperaturer accelerere reaktionen, hvilket giver en hurtigere udvikling af brintgas.
Sidste artikelHvad indikerer -ate eller -ite i slutningen af en forbindelse?
Næste artikelHvad er simple definitioner af organisk stof?
 Varme artikler
Varme artikler
-
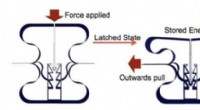 Forskere designer materiale, der kan lagre energi som et ørnegrebDen skraldende byggeklods, der kunne indlejres i de nye materialer. Efter lodret kompression, det holder materialer kollapset, og kan frigive deres energi på side-vejs pull. Kredit:Stoyan Smoukov
Forskere designer materiale, der kan lagre energi som et ørnegrebDen skraldende byggeklods, der kunne indlejres i de nye materialer. Efter lodret kompression, det holder materialer kollapset, og kan frigive deres energi på side-vejs pull. Kredit:Stoyan Smoukov -
 Maler et klart billede af, hvordan nitrogenoxider dannesKredit:CC0 Public Domain Nitrogenoxider (NOx) er nogle af de vigtigste forurenende stoffer i vores atmosfære – de bidrager til dannelsen af smog, sur regn og jordnær ozon. På grund af dette, For
Maler et klart billede af, hvordan nitrogenoxider dannesKredit:CC0 Public Domain Nitrogenoxider (NOx) er nogle af de vigtigste forurenende stoffer i vores atmosfære – de bidrager til dannelsen af smog, sur regn og jordnær ozon. På grund af dette, For -
 Polymerbelægning køler bygninger nedNår de udsættes for himlen, den porøse polymer PDRC-belægning reflekterer sollys og udsender varme for at opnå væsentligt køligere temperaturer end typiske byggematerialer eller endda den omgivende lu
Polymerbelægning køler bygninger nedNår de udsættes for himlen, den porøse polymer PDRC-belægning reflekterer sollys og udsender varme for at opnå væsentligt køligere temperaturer end typiske byggematerialer eller endda den omgivende lu -
 Kølere katalysatorer:Renere luft til alleSommerfuglenes vinger har en specialiseret struktur på nanoskalaen, der giver dem alle deres fysiske egenskaber, inklusive farve, vandafvisende, og termisk regulering. Wyss-forskere har udnyttet disse
Kølere katalysatorer:Renere luft til alleSommerfuglenes vinger har en specialiseret struktur på nanoskalaen, der giver dem alle deres fysiske egenskaber, inklusive farve, vandafvisende, og termisk regulering. Wyss-forskere har udnyttet disse
- Selvbilleddannelse af et molekyle ved dets egne elektroner
- Anmeldelse:2023 Nissan Leaf vs. 2023 Chevy Bolt EV
- Eksplosivt udbrud klipper vulkanen på St. Vincent i Caribien
- Geometriske klynger af cykloner vælter over Jupiters poler
- Olie og vand blandes virkelig-simulerer verden af mikrohydrodynamiske fænomener
- Spild ikke, vil ikke:en hjemmelavet plan om at gøre plast og dæk til brændstof


