Hvordan påvirker en syre pH H plus koncentrationen, når den tilsættes til vand?
Syrer donerer H+ ioner, når de opløses i vand, hvilket fører til en stigning i deres koncentration i opløsningen. Denne stigning i H+ ionkoncentration flytter pH mod lavere værdier, hvilket gør opløsningen mere sur. Omfanget af pH-ændringen afhænger af syrens styrke og den koncentration, den tilsættes ved. Stærke syrer dissocierer fuldstændigt i vand og frigiver et stort antal H+ ioner og forårsager følgelig et mere signifikant fald i pH. Svage syrer, på den anden side, dissocierer delvist, frigiver færre H+ ioner og forårsager en mindre ændring i pH.
Forholdet mellem pH og H+ ionkoncentration er logaritmisk. Det betyder, at en lille ændring i pH svarer til en væsentlig ændring i H+ ionkoncentration. For eksempel repræsenterer et fald i pH fra 7 til 6 en ti gange stigning i H+ ionkoncentration. Tilsvarende repræsenterer en stigning i pH fra 7 til 8 et tidobbelt fald i H+ ionkoncentration.
 Varme artikler
Varme artikler
-
 Smart lægemiddeldesign til at forhindre malariabehandlingsresistensKredit:CC0 Public Domain Resistens mod malaria kan undgås ved at studere, hvordan resistens udvikler sig under udvikling af lægemidler, ifølge et nyt blad offentliggjort i Cellekemisk biologi .
Smart lægemiddeldesign til at forhindre malariabehandlingsresistensKredit:CC0 Public Domain Resistens mod malaria kan undgås ved at studere, hvordan resistens udvikler sig under udvikling af lægemidler, ifølge et nyt blad offentliggjort i Cellekemisk biologi . -
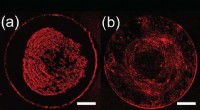 Ny fremstillingsteknik kan forbedre det almindelige problem inden for printteknologiFor figur A, der er partikeltransport til spidsen af måldråben, og der dannes en tæt midteraflejring. For figur B, den endelige kortlagte indbetaling er mere ensartet. Kredit: Langmuir En ny fr
Ny fremstillingsteknik kan forbedre det almindelige problem inden for printteknologiFor figur A, der er partikeltransport til spidsen af måldråben, og der dannes en tæt midteraflejring. For figur B, den endelige kortlagte indbetaling er mere ensartet. Kredit: Langmuir En ny fr -
 Ny udskrivningsproces fremmer 3-D-kapaciteterDette trækobjekt blev skabt ved hjælp af 3D-injektionsprint, en ny teknologi opfundet af UMass Lowell Plastics Engineering Prof. David Kazmer. Kredit:David Kazmer Mere holdbare proteser og medicin
Ny udskrivningsproces fremmer 3-D-kapaciteterDette trækobjekt blev skabt ved hjælp af 3D-injektionsprint, en ny teknologi opfundet af UMass Lowell Plastics Engineering Prof. David Kazmer. Kredit:David Kazmer Mere holdbare proteser og medicin -
 Genbrug af flere ædle metaller fra nukleart og elektronisk affald ved hjælp af Picasso-pigmentet, …Ny metode hjælper med at genvinde guld fra e-affald med en højere hastighed, end det kan udvindes fra frisk malm. Kredit:Reiko Matsushita, Shinta Watanabe Et stort problem med bortskaffelse af nukl
Genbrug af flere ædle metaller fra nukleart og elektronisk affald ved hjælp af Picasso-pigmentet, …Ny metode hjælper med at genvinde guld fra e-affald med en højere hastighed, end det kan udvindes fra frisk malm. Kredit:Reiko Matsushita, Shinta Watanabe Et stort problem med bortskaffelse af nukl
- Lydbølger i lipidfilm kan udslette hinanden ved kollision
- Forskere dokumenterer den første brug af majs i Mesoamerika
- Belysning af vejen til selektiv membranbilleddannelse
- Alt hvad du behøver at vide om Rådhusets klima
- Mindre forudindtaget ansigtsgenkendelse? Microsoft byder på forbedring, IBM tilbyder hjælp
- En demonstration af billeddannelse i det virkelige rum af nogle af de mest repræsentative former fo…


