Hvordan dannes en kovalent mellem atomer?
Styrken af en kovalent binding afhænger af antallet af delte elektronpar mellem atomerne. Jo flere delte elektronpar, jo stærkere binding. For eksempel er en dobbelt kovalent binding, som består af to delte elektronpar, stærkere end en enkelt kovalent binding, som kun består af ét delt elektronpar.
Kovalente bindinger findes i mange forskellige typer molekyler, herunder vand, kuldioxid og metan. De findes også i mange faste stoffer, såsom diamant og grafit.
Her er en mere detaljeret forklaring på, hvordan en kovalent binding dannes:
1. Atomerne kommer tæt på hinanden. Det første skridt i at danne en kovalent binding er, at atomerne kommer tæt på hinanden. Dette kan ske gennem en række forskellige mekanismer, såsom kollision, diffusion eller kemisk reaktion.
2. Atomernes yderste elektroner overlapper hinanden. Når atomerne er tæt på hinanden, kan deres yderste elektroner overlappe hinanden. Denne overlapning skaber et område med høj elektrontæthed mellem atomerne.
3. Elektronerne er delt mellem atomerne. Elektronerne i området med høj elektrontæthed deles mellem atomerne. Denne deling af elektroner skaber en kovalent binding.
Styrken af en kovalent binding afhænger af følgende faktorer:
* Atomernes elektronegativitet. Jo mere ens elektronegativiteterne af atomerne er, jo stærkere er den kovalente binding.
* Antallet af delte elektronpar. Jo flere delte elektronpar mellem atomerne, jo stærkere er den kovalente binding.
* Afstanden mellem atomerne. Jo tættere atomerne er sammen, jo stærkere er den kovalente binding.
Kovalente bindinger er en vigtig type kemisk binding. De findes i mange forskellige typer molekyler og faste stoffer, og de spiller en afgørende rolle for stoffets struktur og funktion.
 Varme artikler
Varme artikler
-
 En potentiel ny solcreme er koralsikker og giver mere UVB/UVA-beskyttelseKredit:CC0 Public Domain En ny undersøgelse offentliggjort i Videnskabelige rapporter har fundet ud af, at methylenblåt, en århundrede gammel medicin, har potentialet til at være en yderst effek
En potentiel ny solcreme er koralsikker og giver mere UVB/UVA-beskyttelseKredit:CC0 Public Domain En ny undersøgelse offentliggjort i Videnskabelige rapporter har fundet ud af, at methylenblåt, en århundrede gammel medicin, har potentialet til at være en yderst effek -
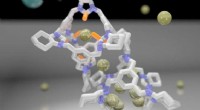 Burmolekyler fungerer som molekylsigter til adskillelse af brintisotopDannelse af en cocrystal forbedrer D2/H2-separationsydelsen. Kredit:University of Liverpool Et nyt hybridmateriale udviklet af forskere ved University of Liverpool kan bringe drømmen om kulstoffri
Burmolekyler fungerer som molekylsigter til adskillelse af brintisotopDannelse af en cocrystal forbedrer D2/H2-separationsydelsen. Kredit:University of Liverpool Et nyt hybridmateriale udviklet af forskere ved University of Liverpool kan bringe drømmen om kulstoffri -
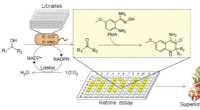 Ny high-throughput screeningsmetode udviklet til ketonerFlowdiagram over PMA-ketonfluorescensscreening. Kredit:Prof. SUN Zhoutongs gruppe Ketoner er af stor betydning som byggesten i syntetisk organisk kemi og biokatalyse. De fleste ketoner kan ikke le
Ny high-throughput screeningsmetode udviklet til ketonerFlowdiagram over PMA-ketonfluorescensscreening. Kredit:Prof. SUN Zhoutongs gruppe Ketoner er af stor betydning som byggesten i syntetisk organisk kemi og biokatalyse. De fleste ketoner kan ikke le -
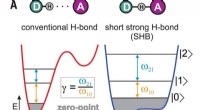 Eksperimenter med bifluoridioner viser tegn på hybridbindingerHydrogenbindinger. (A) Typer af hydrogenbindinger afhængigt af donor-acceptor afstand. Potentialer for protonbevægelse vises sammen med de tre første kvantenniveauer og de tilhørende laveste energiove
Eksperimenter med bifluoridioner viser tegn på hybridbindingerHydrogenbindinger. (A) Typer af hydrogenbindinger afhængigt af donor-acceptor afstand. Potentialer for protonbevægelse vises sammen med de tre første kvantenniveauer og de tilhørende laveste energiove
- Hvordan tilfældige justeringer i timing kan føre til nye spilteoretiske strategier
- Forskning viser potentiale til at forbedre maling, belægninger
- Hvad adskiller aerob fra anaerob respiration?
- Hvad er den flydekraft, der virker på objektet?
- Forskere udvikler et lægemiddel, der stopper kramper
- Klimaændringer skaber ny risiko:Er indlandsbroer for lave?


