Identificer betydningen af cystein i dets dannelse af disulfidbindinger?
Her er betydningen af cystein i dets dannelse af disulfidbindinger:
1. Cystein som en Precursor:Cystein er den eneste aminosyre, der indeholder en reaktiv sulfhydrylgruppe (-SH) i sin sidekæde. Denne thiolgruppe fungerer som det reaktive sted for dannelsen af disulfidbindinger.
2. Oxidations- og reduktionspotentiale:Thiolgruppen af cystein kan gennemgå reversible oxidations-reduktionsreaktioner, hvilket tillader den at danne og bryde disulfidbindinger dynamisk. Disse reaktioner er påvirket af det cellulære redoxmiljø.
3. Stabilisering af proteinstruktur:Disulfidbindinger forbinder kovalent forskellige dele af et protein, hvilket bidrager til dets overordnede strukturelle stabilitet. Ved at danne disse bindinger giver cysteinrester styrke og stivhed til proteinet, hvilket forhindrer det i at udfolde sig eller miste sin konformation.
4. Multimer proteinsamling:Disulfidbindinger er særligt vigtige ved dannelsen af multimere proteiner, hvor flere proteinunderenheder samles for at danne et funktionelt kompleks. De tjener som tværkæder, der holder de individuelle underenheder sammen og opretholder den overordnede arkitektur af proteinsamlingen.
5. Enzymaktivitet og -regulering:Nogle enzymer kræver disulfidbindinger for deres katalytiske aktivitet eller korrekt foldning. Tilstedeværelsen af disulfidbindinger kan modulere enzymfunktionen ved at kontrollere tilgængeligheden af det aktive sted eller de konformationelle ændringer, der er nødvendige for katalyse.
6. Redox-føling og -signalering:Dannelse og reduktion af disulfidbindinger kan fungere som redoxsensorer i celler. Ændringer i redoxtilstanden af cysteinrester kan udløse cellulære responser og signalveje, især i redoxfølsomme proteiner involveret i oxidative stressresponser og redoxregulering.
Samlet set spiller cysteins unikke evne til at danne disulfidbindinger gennem dens reaktive thiolgruppe en kritisk rolle i stabilisering af proteinstrukturer, facilitering af multimer proteinsamling, indflydelse på enzymaktivitet og deltagelse i redoxfølsomme cellulære processer.
Sidste artikelFår eller mister kovalente bindinger ikke elektroner?
Næste artikelHvor mange procent af gasserne indånder du?
 Varme artikler
Varme artikler
-
 Kobberkatalyseret enantioselektiv trifluormethylering af benzylradikaler udvikletKredit:CC0 Public Domain Forskere fra Shanghai Institute of Organic Chemistry ved det kinesiske videnskabsakademi (CAS) har udviklet den første kobberkatalyserede enantioselektive trifluormethyler
Kobberkatalyseret enantioselektiv trifluormethylering af benzylradikaler udvikletKredit:CC0 Public Domain Forskere fra Shanghai Institute of Organic Chemistry ved det kinesiske videnskabsakademi (CAS) har udviklet den første kobberkatalyserede enantioselektive trifluormethyler -
 Biochar kan øge kulstoflageret, men fordele for spiring og vækst synes knappeIllinois Sustainable Technology Center forskere Elizabeth Meschewski, venstre, og Nancy Holm og samarbejdspartnere udviklede en systematisk undersøgelse for at teste effektiviteten af jordadditiv bi
Biochar kan øge kulstoflageret, men fordele for spiring og vækst synes knappeIllinois Sustainable Technology Center forskere Elizabeth Meschewski, venstre, og Nancy Holm og samarbejdspartnere udviklede en systematisk undersøgelse for at teste effektiviteten af jordadditiv bi -
 Forskere ser kemisk rækkevidde i mellem-entropi-legeringKredit:CC0 Public Domain Kinesiske forskere har foretaget direkte observationer af ansigtscentrerede kubiske VCoNi (medium) -entropylegeringer (MEA) og for første gang foreslået en overbevisende i
Forskere ser kemisk rækkevidde i mellem-entropi-legeringKredit:CC0 Public Domain Kinesiske forskere har foretaget direkte observationer af ansigtscentrerede kubiske VCoNi (medium) -entropylegeringer (MEA) og for første gang foreslået en overbevisende i -
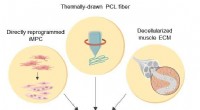 Biokonstrueret hybrid muskelfiber til regenerativ medicinSkematisk illustration af de 3D-skeletmuskellignende biomanipulerede konstruktioner Kredit:Institut for Grundvidenskab Muskler udgør det største organ hos mennesker, tegner sig for 40% af kropsmas
Biokonstrueret hybrid muskelfiber til regenerativ medicinSkematisk illustration af de 3D-skeletmuskellignende biomanipulerede konstruktioner Kredit:Institut for Grundvidenskab Muskler udgør det største organ hos mennesker, tegner sig for 40% af kropsmas
- Modificeret arylomycin viste sig at være effektivt mod lægemiddelresistente bakterier
- Skatte under havbunden? Havvand spiller en rolle i gulddannelsen
- Er vand syrebase eller salt?
- Forståelse af rødder åbner eleverne for videnskab, mangfoldighed
- Hvordan vokser planteceller?
- Hvordan koraller, der genkoloniserede Bikini-atollen efter atombombeforsøg, tilpassede sig vedvaren…


