Hvad har stærk syre til fælles med ionforbindelse?
1. Fuldstændig dissociation:Stærke syrer dissocierer fuldstændigt i vand og frigiver alle deres hydrogenioner (H+). På samme måde dissocierer ioniske forbindelser til deres konstituerende ioner, når de opløses i vand.
2. Høj ledningsevne:Stærke syrer og ioniske forbindelser er begge gode ledere af elektricitet i vandige opløsninger. Tilstedeværelsen af frit bevægende ioner tillader i begge tilfælde strømmen af elektrisk strøm.
3. Syre-basereaktioner:Stærke syrer donerer hydrogenioner (H+) i syre-base reaktioner, hvilket fører til dannelsen af hydroniumioner (H3O+). I tilfælde af ioniske forbindelser kan nogle ioner deltage i syre-basereaktioner, hvilket bidrager til opløsningens overordnede sure eller basiske natur.
4. Reaktion med metaller:Stærke syrer reagerer med aktive metaller og danner brintgas (H2) og et salt. På samme måde reagerer nogle ioniske forbindelser med metaller, undergår redoxreaktioner og danner nye forbindelser.
5. pH-værdi:Stærke syrer har en lav pH-værdi, typisk under 7, på grund af deres høje koncentration af brintioner. Ligeledes kan opløsninger af ioniske forbindelser have varierende pH-værdier afhængigt af arten af de tilstedeværende ioner.
6. Ætsende:Stærke syrer er ætsende i naturen, hvilket betyder, at de kan beskadige levende væv og materialer. På samme måde kan nogle ioniske forbindelser udvise ætsende egenskaber på grund af deres ioners reaktivitet.
7. Dannelse af salte:Stærke syrer reagerer med baser eller metalcarbonater og danner salte og vand. Ioniske forbindelser er per definition salte sammensat af positivt ladede ioner (kationer) og negativt ladede ioner (anioner).
Selvom disse fælles træk eksisterer mellem stærke syrer og ioniske forbindelser, er det vigtigt at bemærke, at ikke alle ioniske forbindelser er sure, og ikke alle stærke syrer er ioniske forbindelser. Forståelse af disse ligheder hjælper dog med at forstå deres kemiske adfærd og egenskaber i vandige opløsninger.
Sidste artikelHvordan afbalancerer du Cl2 plus H2O er lig med HCl HClO3?
Næste artikelKan metaller have positive og negative oxidationstal?
 Varme artikler
Varme artikler
-
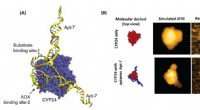 Lovende anticancer-molekyle identificeretFigur 1. En integreret tilgang til HS-AFM og molekylær docking for at afsløre bindingsmekanismen for Apt-7 til CYP24 (A) Den tredimensionelle visning af de toprangerede dockede konformationer af CYP24
Lovende anticancer-molekyle identificeretFigur 1. En integreret tilgang til HS-AFM og molekylær docking for at afsløre bindingsmekanismen for Apt-7 til CYP24 (A) Den tredimensionelle visning af de toprangerede dockede konformationer af CYP24 -
 Høje reaktionshastigheder selv uden ædle metallerI denne afskærmede celle, Abdelilah El Arrassi tester nanopartiklerne i elektrokemiske eksperimenter. Kredit:RUB, Kramer Nanopartikler af ikke-ædelmetal kan en dag erstatte dyre katalysatorer til
Høje reaktionshastigheder selv uden ædle metallerI denne afskærmede celle, Abdelilah El Arrassi tester nanopartiklerne i elektrokemiske eksperimenter. Kredit:RUB, Kramer Nanopartikler af ikke-ædelmetal kan en dag erstatte dyre katalysatorer til -
 Forskningsgennembrud kan transformere ren energiteknologiKredit:Pixabay/CC0 Public Domain Efter nogle skøn, mængden af solenergi, der når jordens overflade på et år, er større end summen af al den energi, vi nogensinde kunne producere ved hjælp af i
Forskningsgennembrud kan transformere ren energiteknologiKredit:Pixabay/CC0 Public Domain Efter nogle skøn, mængden af solenergi, der når jordens overflade på et år, er større end summen af al den energi, vi nogensinde kunne producere ved hjælp af i -
 Angriber tumorer direkte ved identifikationKredit:CC0 Public Domain Teranostik, kombinationen af terapi og diagnostik, henviser til lægemidler, der ikke kun bruges til at behandle tumorer, men også til at gøre dem synlige. Princippet er
Angriber tumorer direkte ved identifikationKredit:CC0 Public Domain Teranostik, kombinationen af terapi og diagnostik, henviser til lægemidler, der ikke kun bruges til at behandle tumorer, men også til at gøre dem synlige. Princippet er
- Store superkrystaller lover overlegne sensorer
- Power Loom:En essentiel industriel revolution opfindelse
- Systemisk racisme findes i sundhedsvæsenet, så det er tid til at tage ansvar og investere i løsni…
- Er hyolitter palæozoiske lophophorater?
- Byens varmeø-effekter afhænger af en bys layout
- Facebooks digitale valuta kan blomstre i den analoge verden


