Hvis 250,3 L hydrogengas (d 0,0899gL ) reagerer med et overskud af nitrogen, hvilken masse af ammoniak ville der blive produceret?
Trin 1:Beregn antallet af mol brintgas (H2)
Vi kan bruge den ideelle gaslov:
PV =nRT
hvor P er trykket, V er rumfanget, n er antallet af mol, R er idealgaskonstanten, og T er temperaturen.
Forudsat standard temperatur og tryk (STP), hvor P =1 atm og T =0 °C (273,15 K), har vi:
n(H2) =PV/RT =(1 atm)(250,3 L)/(0,08206 L atm/mol K)(273,15 K)
n(H2) =10,64 mol
Trin 2:Bestem den begrænsende reaktant
Fra den afbalancerede kemiske ligning for reaktionen mellem brint og nitrogen for at producere ammoniak:
N2 + 3H2 -> 2NH3
Vi kan se, at 1 mol nitrogen (N2) reagerer med 3 mol hydrogen (H2). Derfor er vi nødt til at sammenligne antallet af tilgængelige mol hydrogen (10,64 mol) med antallet af nødvendige mol nitrogen (10,64 mol / 3 =3,55 mol).
Da vi har et overskud af nitrogen, vil brint være den begrænsende reaktant.
Trin 3:Beregn det teoretiske udbytte af ammoniak (NH3)
Fra den afbalancerede kemiske ligning ved vi, at 3 mol brint producerer 2 mol ammoniak. Derfor kan det teoretiske udbytte af ammoniak beregnes som følger:
n(NH3) =(2/3) × n(H2)
n(NH3) =(2/3) x 10,64 mol
n(NH3) =7,09 mol
Trin 4:Beregn massen af ammoniak (NH3)
Endelig kan vi beregne massen af ammoniak (NH3) produceret ved hjælp af dens molære masse (17,04 g/mol):
masse(NH3) =n(NH3) × molær masse(NH3)
masse (NH3) =7,09 mol x 17,04 g/mol
masse (NH3) =120,8 g
Derfor er massen af ammoniak produceret i denne reaktion 120,8 gram.
 Varme artikler
Varme artikler
-
 Forskning afdækker det første ikke-centrosymmetriske fluorooxosilicophosphat med Si-F-bindingerSkematisk illustration af forskningen. Kredit:Prof. LUOs gruppe Dyb-ultraviolette (UV) ikke-lineære optiske materialer spiller en afgørende rolle i en række forskellige højteknologiske videnskabel
Forskning afdækker det første ikke-centrosymmetriske fluorooxosilicophosphat med Si-F-bindingerSkematisk illustration af forskningen. Kredit:Prof. LUOs gruppe Dyb-ultraviolette (UV) ikke-lineære optiske materialer spiller en afgørende rolle i en række forskellige højteknologiske videnskabel -
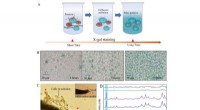 Ny SERS-strategi udviklet til beta-galactosidase aktivitetsanalyseIn-situ SERS udlæsningsstrategi for individuelle celler. (A) Skematisk strategi for at forbedre pålideligheden ved at forkorte farvningstider. (B) X-gal farvning assay for celler. (C og D) In-situ SER
Ny SERS-strategi udviklet til beta-galactosidase aktivitetsanalyseIn-situ SERS udlæsningsstrategi for individuelle celler. (A) Skematisk strategi for at forbedre pålideligheden ved at forkorte farvningstider. (B) X-gal farvning assay for celler. (C og D) In-situ SER -
 Vi gifter os med uorden med orden:Virkningerne af geometrisk lidelse på væsker og faste stoffer i …Professor Rustem Valiullin med et nuklear magnetisk resonansspektrometer. Kredit:Swen Reichhold, Leipzig Universitet Vi har alle stødt på dem før:de små poser med små bolde, der kommer pakket samm
Vi gifter os med uorden med orden:Virkningerne af geometrisk lidelse på væsker og faste stoffer i …Professor Rustem Valiullin med et nuklear magnetisk resonansspektrometer. Kredit:Swen Reichhold, Leipzig Universitet Vi har alle stødt på dem før:de små poser med små bolde, der kommer pakket samm -
 Ny legering kan direkte reducere vægten af varmefjernelsessystemer med en tredjedelKredit:National University of Science and Technology MISIS De nye legeringer skabt af NUST MISIS-forskere i samarbejde med LG Electronics vil hjælpe med at reducere vægten af radiatorer og varme
Ny legering kan direkte reducere vægten af varmefjernelsessystemer med en tredjedelKredit:National University of Science and Technology MISIS De nye legeringer skabt af NUST MISIS-forskere i samarbejde med LG Electronics vil hjælpe med at reducere vægten af radiatorer og varme


